
|
Читайте также: |
Рассмотрим реакцию восстановления трехокиси урана
3 UO3 + CO = U3O8 + CO2
Для анализа применим правило фаз
f = k – p + 1
имеем K = 3, P = 3. Следовательно f = 1.
Система обладает одной степенью свободы, т.е. произвольно можно задавать лишь один параметр; все остальные параметры будут функцией этого параметра. Состояние же рассматриваемой системы определяется температурой и составом газовой фазы. В качестве независимого параметра возьмем температуру. Тогда состав газовой фазы будет некоторой функцией от температуры.
Для расчета состава газовой фазы можно воспользоваться двумя следующими уравнениями:
1. 
2. 
Следовательно, для того, чтобы рассчитать состав равновесной газовой фазы при данной температуре, необходимо знать значение константы равновесия. А для этого нужно знать зависимость константы равновесия от температуры.
Для нахождения K = f(T) рассматриваемую реакцию представим как сумму двух следующих процессов:
а) 3 UO3 = U3O8 + 0,5 O2
б) СO + 0,5O2= CO2
а) + б) = 3 UO3 + CO = U3O8 + CO2
Примем следующие обозначения:
ΔZ0 – стандартное изменение изобарного потенциала для суммарной реакции;
ΔZ0a – то же самое для реакции а);
ΔZ0б – то де самое для реакции б).
Тогда на основании закона, аналогичного закону Гесса, можно написать:
∆Z0= ∆Z0α+ ∆Z0δ
Но так как,

то,

где К1 – константа равновесия для реакции восстановления трехокиси урана окисью углерода. Зависимость lgКа от температуры давалась раньше при рассмотрении процессов диссоциации окислов урана, а именно:

Реакция б – реакция горения окиси углерода хорошо изучена, и в литературе приводится зависимость константы равновесия этой реакции от температуры, а именно:

Подставляя эти значения, получаем следующее уравнения для константы равновесия рассматриваемой реакции:
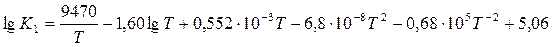
Для приближенного расчета часто используется энтропийное уравнение Улиха:

где 
Значения теплоемкостей и энтропий веществ, участвующих в процессе приводятся в таблице 3:
Таблица 3
| Вещество | S298 | CP298 |
| UO3 | 23,57 | 20,3 |
| U3O8 | 67,53 | 59,3 |
| CO | 47,42 | 6,80 |
| CO2 | 51,08 | 8,94 |
Используя эти данные, получим:

Результаты подсчета по приведенным уравнениям даются в табл. 4.
Таблица 4
| Т 0К | |||
| lgK1 | 19,91 | 10,05 | 6,94 |
| lgK’1 | 18,41 | 9,54 | 6,13 |
Из данных таблицы следует, что значение константы равновесия, подсчитанное по приближенному уравнению Улиха, довольно хорошо совпадает со значением, полученным по более точному уравнению. Посмотрим теперь значения константы равновесия:
500 0К – К=1019,91
1500 0К – К=106,94
При всех взятых нами температурах К – величина значительная. Если рассчитать составы равновесных газовых фаз, то увидим, что практически газовая фаза при всех температурах состоит из одной двуокиси углерода. А это дает основание считать, что реакция восстановления трехокиси углерода окисью углерода является практически необратимой. Следовательно, с помощью двуокиси углерода нельзя закись – окись урана окислять до трехокиси.
Дата добавления: 2015-10-28; просмотров: 99 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| UO3 – трехокись урана | | | Восстановление двуокиси урана (UO2). |