
Примем в дальнейшем следующие обозначения:
Металл –Ме, газ – Г2 (Н2, О2, N2 и т.д.).
Взаимодействие двухатомного газа с металлом в общем виде можно отобразить следующим уравнением:
yMe + xГ2 = МеyГ2х
Константа равновесия для этого процесса запишется следующим образом:

Но если учесть, что давление газа над металлом не значительно, то это выражение можно упростить, так как
аМе = 1, аГ2 = РГ2
Кроме того, вследствие того, что содержание газа в металле невелико, можно считать, что
аМе у Г2 х = [Меу Г2х] = K1 [Г2х]
В результате получаем:
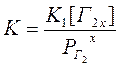
Отсюда
 (3)
(3)
где 
Таким образом, приходим к выводу, что растворимость газа в металле пропорциональна давлению газа под металлом в степени Х.
Экспериментальное определение значения Х дает возможность выяснить характер группировок, возникающих при растворении газа в металле. Если Х = 1, то
РГ2 = К′[Г2],
т.е. получаем обычный закон Генри, и можно утверждать, что в металле возникают группировки, содержащие по одной молекуле газа. Если Х – дробное число, то можно сделать иное заключение.
Эксперименты по изучению изотерм растворимостей водорода, кислорода, азота показали, что Х = 1/2. Так, в частности, Карнаухов и Морозов изучали растворимость водорода в железе при 1685°С и нашли, что Х = 0,5 (0,46 – 0,5). Но если
Х = 1/2, то написанное ранее уравнение (3) приобретает вид:
 (4)
(4)
Справедливость так называемого закона квадратного корня позволяет предположить, что при растворении двухатомного газа в металле происходит диссоциация молекулы газа на атомы и в металле возникают группировки, содержащие по одному атому газа. Ничего больше на основании этого сказать нельзя. В частности, нельзя сказать, чему равен у. Также нельзя отдать предпочтение какому–нибудь одному из трех возможных состояний газа: ионному, атомарному или молекулярному. Т.е. нельзя ничего сказать о характере сил взаимодействия между металлом и газом.
Некоторые дополнительные данные можно получить путем изучения изобар растворимости газа в металле. Эти исследования, в частности, дают возможность подсчитать тепловой эффект процесса растворения ∆Н.
Подобные исследования показали, что растворимость газа в металле, как правило, увеличивается с повышением температуры. А это означает, что суммарный процесс растворения – процесс эндотермический (∆Н > 0).
Силы взаимодействия между молекулами в газовой фазе невелики и на отрыв молекулы не приходится затрачивать значительного количества тепла. Собственно взаимодействие газа с металлом значительно и протекает с выделением тепла.
Для того, чтобы суммарный процесс был эндотермическим, необходимо наличие промежуточной стадии, протекающей с поглощением значительного количества тепла. Можно полагать, что такой стадией является диссоциация молекулы газа на атомы. Она протекает на поверхности металла, причем силовое поле последнего облегчает процесс диссоциации.
Рассмотрим следующий термодинамический цикл:

где ∆Н – тепловой эффект суммарного процесса,
ДГ2 – теплота диссоциации Г2 на атомы,
∆НМе-Г – тепловой эффект взаимодействия газа с металлом.
На основании закона Гесса можно записать:

но ∆НМе-Г < 0, т.к. тепло выделяется. ДГ2 > 0, т.к. на диссоциацию затрачивается тепло. Для того, чтобы ∆Н было больше нуля, необходимо чтобы
ДГ2 > ∆НМе-Г.
Таким образом, изучении изотерм и изобар растворимостей дает возможность сделать следующие выводы:
1. При растворении газов в металле происходит диссоциация молекулы газа на атомы, и в металле возникают группировки, содержащие по одному атому газа.
2. Ничего нельзя сказать о характере сил взаимодействия между атомами металла и газа. Можно утверждать только, что теплота взаимодействия между металлом и газами значительно.
Это можно проиллюстрировать следующим примером: теплота растворения водорода в железе ∆Н = 15000 – 16000 кал/моль; теплота разложения молекулы водорода ДН2 = 101000 кал/моль. Отсюда получаем, что энергия взаимодействия между водородом и железом:
∆НМе-Н = - 85000 кал/моль,
т.е. величина значительная.
В некоторых случаях имеет место соотношение:
ДГ2 < ∆НМе-Г.
Тогда для суммарного процесса растворения ∆Н < 0, т.е. процесс протекает с выделением тепла. Поэтому растворимость газа в металле уменьшается с повышением температуры. В частности, это наблюдается при растворении водорода в натрии, калии, кальции.
1.
Дата добавления: 2015-10-28; просмотров: 231 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| ОСНОВЫ МЕТАЛЛОТЕРМИИ | | | Система смазки |