
|
Читайте также: |
К настоящему времени имеются сведения о существовании по крайней мере пяти кристаллических и одной рентгеноаморфной модификации трехокиси урана.
Трехокись урана – полупроводник с избытком металла. Электропроводность ее вплоть до 300°С очень мала. Большинство исследователей считает трехокись урана парамагнитной.
Зависимость теплоемкости от температуры дается уравнением:
Ср = 22,09 + 2,54 * 10-3*Т – 2,973 * 105 * Т-2
Энтропия при 298°К равна 23,57 ± 0,06 э.е.
1.2. Фазовые соотношения в системе уран-кислород.
Изучение фазовых соотношений в системе уран – кислород проведено, в основном, за последние двадцать пять лет.
Фазовые соотношения в данной системе весьма сложны и не всегда достаточно достоверно установлены. Последнее в значительной степени объясняется тем, что на многих участках диаграммы состояния трудно реализовать равновесие из-за очень малой скорости фазовых превращений в твердом состоянии. Вследствие этого ряд вопросов остается дискуссионным и требует дальнейшего изучения.
1.2.1. U – UO2
Область между металлическим ураном и двуокись урана относительно проста и подробно описана. Растворимость металлического урана в двуокиси очень мала, так же как и растворимость двуокиси в уране. В области U – UO2 при любом отношении кислорода к урану в твердых фазах система состоит из двух фаз: металлический уран и двуокись (при температурах ниже 1200 К).
1.2.2. UO2 – UO2,25
Эта область системы уран-кислород подробно изучалась многими исследователями. В решетке типа флюорита имеется достаточно пространства для внедрения кислорода. Поэтому на базе этой решетки образуется фаза UO2+x – нестехиометрического состава с широкой областью гомогенности. Верхний предел содержания кислорода в этой фазе зависит от температуры, а именно: UO2,05 при 450°С; UO2,10 при 550°С; UO2,15 при 850° и UO2,20 при 940°С.
Препарат U4O9 (UO2,25) в области температур от 100 – 950°С однофазен. При 900°С область гомогенности окислов U4O9 простирается от UO2,24 до UO2,26.
Шанер считает, что U4O9 обладает несколько более широкой областью гомогенности, которая простирается от UO2,20 до UO2,25 при 940°С и от UO2,22 до UO2,25 при комнатной температуре. В остальной части рассматриваемой области составов система двухфазна; одновременно сосуществуют фазы: UO2+x – U4O9-у. На рис. 3 приведена диаграмма состояния системы UO2 – U4O9.
1.2.3. UO2,25 – UO2,67
Большие расхождения имеются у исследователей относительно тетрагональных фаз. Обобщая имеющиеся в литературе данные, можно считать, что тетрагональные фазы устойчивы только в сравнительно узкой области температур, верхний предел которой уменьшается от 500°С для UO2,30 до менее чем 400°С для UO2,41.
Между окислами U4O9 и U3O8 кроме тетрагональных фаз обнаружен еще окисел U2O5.
На рис. 4 приводится диаграмма состояния системы UO2 – U3O8.
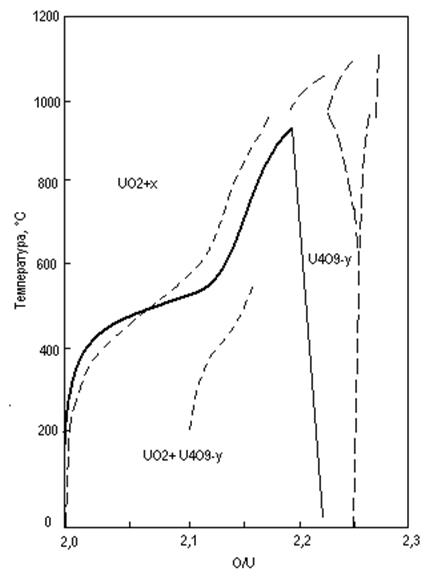
Рис. 3

Рис. 4
1.2.4. UO2,67 – UO3
Фазовые переходы в этой области очень сложны и многообразны. В первую очередь это объясняется тем, что верхний предел этой области (UO3) имеет помимо аморфной еще пять кристаллических модификаций.
На рис. 5 приводится обобщенная диаграмма состояния системы уран – кислород.

Рис. 5
1.3. Диссоциация окислов урана.
Принципиально возможны два пути диссоциации окисла металлов:
1. путем отщепления кислорода;
2. путем отщепления металла.
Практическое значение имеет лишь первый путь. Но когда в результате взаимодействия металла с кислородом образуется несколько окислов, вопрос о диссоциации того или иного окисла в значительной степени усложняется. Возьмем, например, трехокись урана. Можно написать следующие реакции диссоциации этого окисла путем отщепления кислорода:
UO3 → U3O8 + O2
UO3 → U4O9 + O2
UO3 → UO2 + O2
UO3 → U + O2
Возникает вопрос: как же на самом деле в природе происходит диссоциация этого окисла? Для того, чтобы ответить на этот вопрос воспользуемся принципом последовательности химических превращений А. А. Байкова: «Всякое химическое превращение протекает последовательно, скачками проходя через все соединения, которые существуют в данной системе».
Для системы уран – кислород напишем ряд в порядке последовательного изменения химического состава:
UO3 → U3O8 → U4O9 → UO2 → U
В этот ряд не включена моноокись урана, так как при температурах ниже
1200 К она термодинамически неустойчива.
При термодинамическом анализе процессов диссоциации окислов урана сделаем следующие допущения.
1. Анализ равновесия с участием твердых фаз переменного состава довольно сложен, ибо часто неизвестны активности компонентов твердой фазы. Поэтому будем производить анализ только процессов с участием твердых фаз постоянного состава, относя последние к составу ближайшего окисла.
2. Равновесное давление кислорода невелико, поэтому можно считать, что активности твердых фаз равны 1, активности газообразных веществ равны их парциальному давлению.
Напишем совокупность реакций, протекающих при последовательном отщеплении кислорода от окислов урана:
1) 3 UO3 = U3O8 + 0,5 O2
2) 0,8 U3O8 = 0,6 U4O9 + 0,5 O2
3) U4O9 = 4 UO2 + 0,5 O2
4) 0,5 UO2 = 0,5U + 0,5 O2
Возьмем первую реакцию и к анализу ее припишем правило фаз:
f = k – p + 2
где f – число степеней свободы,
k -число компонентов,
p – число фаз.
При этом известно, что число компонентов равно числу составных частей системы минус число реакций, протекающих между составными частями в данных условиях. Для взятой нами системы: k = 2, p = 3, f = 1. Так как f = 1, то это означает, что из общего количества параметров, определяющих состояния системы, произвольно можно задавать лишь один. Все остальные параметры будут являться функцией этого параметра.
Состояние взятой нами равновесной системе определяется температурой и парциальным давлением кислорода ( ).
).
В качестве независимого параметра берем температуру. Тогда:  . Следует напомнить, что равновесное давление кислорода по реакции диссоциации носит название упругости диссоциации данного окисла.
. Следует напомнить, что равновесное давление кислорода по реакции диссоциации носит название упругости диссоциации данного окисла.
Запишем выражение константы равновесия для реакции 1:

Аналогично можно подойти к анализу всех остальных реакций. Только когда рассматриваем 4 реакцию, необходимо учесть следующее: металлический уран в твердом состоянии имеет три модификации. Кроме этого он может находиться в жидком состоянии. Поэтому в зависимости от температуры протекает одна из следующих реакций:
4а) 0,5UO2 = 0,5Uα + 0,5O2 (T< 940ºK)
4б) 0,5UO2 = 0,5Uβ + 0,5O2 (940< T <1045ºK)
4в) 0,5UO2 = 0,5Uγ + 0,5O2 (1045 <T < 1406ºK)
4г) 0,5UO2 = 0,5Uж + 0,5O2 (T>1406ºK)
Для того, чтобы иметь зависимость упругости диссоциации того или иного окисла от температуры необходимо знать изменение константы равновесия с температурой. Поэтому для нахождения интересующей нас зависимости необходимо иметь следующие исходные данные:
1. Теплоемкости веществ, участвующих в реакции, как функции температуры.
2. Значение ∆Н298.
3. Значение ∆Z0298.
Довольно часто в таблицах отсутствуют значения ∆Н298 и ∆Z0298 для интересующего нас процесса. В этом случае они могут быть подсчитаны на основе закона Гесса.
В таблице 1 приводятся значения ∆Н298 и ∆Z0298 для реакций образования окислов урана из элементов, а также зависимости теплоемкостей окислов и кислорода и урана от температуры.
Таблица 1
| Вещество | ∆H298, ккал/моль | ∆Z0298, ккал/моль | Ср, кал/град*моль |
| UO3 | -291,1 | -273,1 | 22,09+2,54*10-3T-2,473*105T-2 |
| U3O8 | -856,3 | -804,1 | 62,6+6,6*10-3T-2,5*105T-2 |
| U4O9 | -1080 | -1024 | 79,28+7,56*10-3T-11,1*105T-2 |
| UO2 | -259,6 | -246,9 | 19,20+1,62*10-3-3,951*105T-2 |
| O2 | 6,5+1,0*10-3 | ||
| Uα | 3,15+8,44*10-3T+0,8*105T-2 | ||
| Uβ | 10,38 | ||
| Uγ | 9,10 |
Для теплоемкости жидкого урана достоверных данных нет. В дальнейшем принимаем СрUж =СрUг = 9,10. Теплоты модификационных превращений для урана имеют следующие значения:
ΔHαβ = 665 кал/моль
ΔHβγ = 1170 кал/моль
ΔHпл = 3000 кал/моль
На основании этих данных имеем следующие выражения для констант равновесия, написанных выше реакций:




Результаты подсчета по этим уравнениям приведены в табл. 2.
Таблица 2
| lgK | Т, °C | |||
| lgK1 | -5,53 | -0,048 | 1,66 | 2,58 |
| lgK2 | -11,17 | -3,38 | -0,922 | 0,300 |
| lgK3 | -14,73 | -5,53 | -2,28 | -0,78 |
| lgK4 | -51,20 | -24,24 | -14,08 | -10,26 |
На рис. 6 дается номограмма упругостей диссоциации окислов, построенная на основании этих данных.
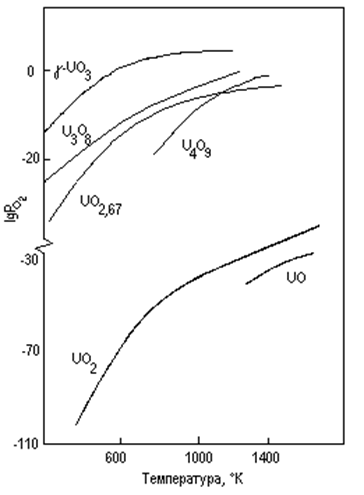
Рис. 6
1.4. Восстановление окислов урана окисью углерода
Под восстановлением понимается процесс превращения окисла в металл или низкий окисел путем отнятия кислорода от исходного окисла каким-либо веществом, называемым восстановителем. В качестве восстановителей в технике чаще всего используется СО, Н2, С. Кроме этого, иногда применяют NH3, CH4 и др. Все процессы восстановления делят на две группы:
1. восстановление с помощью газообразного восстановителя; такой процесс называется косвенным или непрямым восстановлением;
2. восстановление твердым углеродом, которое называется углетермическим или прямым восстановлением.
В технологии металлического урана и его солей процессы косвенного восстановления окислов урана находят довольно широкое применение. В частности, восстановлением высших окислов урана окисью углерода получают порошок двуокиси с очень чистой поверхностью.
Пользуясь принципом Байкова, можно записать следующую совокупность реакций, протекающих при действии окиси углерода на окислы урана:
1) 3 UO3 + CO = U3O8 + CO2
2) 0,8 U3O8 + CO = 0,6 U4O9 + CO2
3) U4O9 + CO = 4 UO2 + CO2
4) 0,5 UO2 + CO = 0,5 U + CO2
Все эти реакции протекают без изменения числа газовых молекул. Поэтому, на основании принципа Ле-Шателье – Вант-Гоффа, давление не оказывает влияние на равновесие по этим реакциям, т.е. состав равновесной газовой фазы не зависит от давления. Так как обычно давление невелико, то можно считать, что активности твердых фаз равны единице, а активности газообразных компонентов равны их парциальным давлениям. Тогда для любой из написанных выше реакций можно записать следующее выражение константы равновесия:

Дата добавления: 2015-10-28; просмотров: 184 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| UO2 – двуокись урана | | | Восстановление трехокиси урана |