
Читайте также:
|
Сократительная функция миокарда — один из основных факторов, определяющих состояние кровообращения. В конечном итоге сокращение кардиомиоцитов происходит при связывании ионов кальция с актин-тропонин-тропомиозиновым комплексом. Усиление сократимости миокарда может быть обусловлено увеличением скорости нарастания концентрации ионов кальция в кардиомиоцитах или повышением чувствительности к нему сократительных белков.
Повышение количества внутриклеточного кальция может быть обусловлено следующими факторами (рис. 14-1). • Угнетение активности Na+,K+-ATcDa3bi. Na+,K+-ATOa3a — основная точка приложения действия сердечных гликозидов.
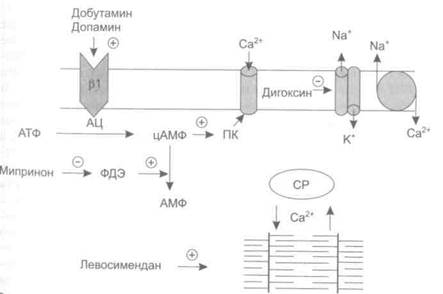
гис. 14-1. Механизм действия препаратов с положительным инотропным эффектом. АЦ — аденилатциклаза, ПК — протеинкиназа, ФДЭ — фосфоди-эстераза, СР — саркоплазматический ретикулум.
 336 -О- Клиническая фармакология ♦ Часть II <• Глава 14
336 -О- Клиническая фармакология ♦ Часть II <• Глава 14
• Повышение содержания циклического аденозинмонофосфата (цАМФ) в кардиомиоцитах [при стимуляции р,-адренорецепторов (добутамин, допамин), торможении активности фосфодиэстеразы (амринон)].
• Повышение чувствительности сократительных белков кардиомио-цитов к ионам кальция (левосимендан).
Сердечные гликозиды
Сердечные гликозиды применяют при сердечной недостаточности вследствие сочетания у них трёх основных фармакодинамических эффектов: отрицательного хронотропного, неиромодулирующего и положительного инотропного. За более чем 200-летний период применения интерес к этой группе препаратов угасал и снова возрождался. До настоящего времени некоторые аспекты их клинического использования до конца не изучены.
Классификация
Традиционно сердечные гликозиды подразделяют на полярные (гидрофильные) и неполярные (липофильные). Полярные сердечные гликозиды хорошо растворяются в воде, плохо — в липидах, недостаточно всасываются в ЖКТ, незначительно связываются с белками плазмы крови, практически не подвергаются биотрансформации и выделяются в основном почками. К этой группе препаратов относятся строфантин, коргликон. По мере снижения полярности гликозиды становятся более липофильными, повышается абсорбция в ЖКТ, в большей степени связываются с белками плазмы крови, подвергаются печёночной биотрансформации. По степени липофильности в порядке её нарастания сердечные гликозиды можно распределить следующим образом: ланатозид Ц < дигоксин < метилдигоксин < дигитоксин. В клинической практике сохраняют своё значение дигоксин, ланатозид Ц и строфантин. Дигитоксин применяют редко в связи с большим Т, а фармакодинамические эффекты корглико-на наименее выражены. Применение строфантина ограничено стационарными условиями. Метилдигоксин отличается от дигоксина лучшей всасываемостью, что, однако, существенно не влияет на основные фармакодинамические параметры, поэтому препарат практически не применяют.
Инотропные лекарственные средства ♦ 337
Механизм действия и основные фармакодинамические эффекты
Сердечные гликозиды угнетают Na+,K+-ATOa3y (натриевый насос) кардиомиоцитов. В результате происходит накопление в цитоплазме ионов натрия, что вызывает повышение содержания ионов кальция и стимуляцию взаимодействия нитей актина и миозина.
Основные фармакодинамические эффекты сердечных гликозидов — положительный инотропный, отрицательные дромотропный и хро-нотропный эффекты. Положительное батмотропное действие проявляется при введении препаратов в субтоксических и токсических дозах (связано с повышением в клетке содержания Са2+ и снижением К+).
• Положительное инотропное действие сердечных гликозидов проявляется увеличением силы и скорости сокращения миокарда. В результате усиления сократимости увеличиваются ударный и минутный объёмы. Снижение конечного систолического и конечного диастолического объёма сердца наряду с повышением тонуса кардиомиоцитов приводит к уменьшению размеров сердца и снижению потребности миокарда в кислороде.
• Отрицательное дромотропное действие сердечных гликозидов проявляется повышением рефрактерности предсердно-желудочкового узла, поэтому эти препараты применяют при пароксизмах супра-вентрикулярных тахикардии и тахиаритмий. При тахисистоличес-кой форме фибрилляции предсердий сердечные гликозиды способствуют снижению частоты желудочковых сокращений, удлиняют диастолу, вследствие чего улучшается внутрисердечная и системная гемодинамика. У больных с нарушением предсердно-желудочковой проводимости сердечные гликозиды могут вызвать дальнейшее её ухудшение вплоть до АВ-блокады и появления приступов Морга-ньи-Адамса-Стокса. При синдроме Вольфа-Паркинсона-Уайта сердечные гликозиды, замедляя АВ-проводимость, способствуют проведению импульсов в обход АВ-узла и тем самым провоцируют развитие пароксизмальной тахикардии.
• Отрицательное хронотропное действие сердечных гликозидов характеризуется снижением ЧСС главным образом вследствие снижения автоматизма синусового узла. Повышая тонус блуждающего нерва (в результате рефлекса с рецепторов дуги аорты и каротидно-го синуса при повышении сердечного выброса), сердечные гликозиды снижают давление в устье полых вен и правом предсердии, что приводит к устранению рефлекса Бейнбриджа, устраняют
 338 ♦ Клиническая фармакология -♦• Часть II -О- Глава 14
338 ♦ Клиническая фармакология -♦• Часть II -О- Глава 14
рефлекторную активацию симпатической нервной системы в ответ
на увеличение сердечного выброса. В последние годы большое значение придают нейромодулирующему действию сердечных гликозидов, развивающемуся при приёме их уже в низких дозах и связанному с угнетением симпатической нервной системы (снижение содержания норадреналина в крови). Ингибирование Na+,K+-ATOa3bi в клетках эпителия почечных канальцев приводит к уменьшению реабсорбции Na+, при этом поступление Na+ к дис-тальным почечным канальцам возрастает, секреция ренина снижается.
Фармакокинетика
Всасывание дигоксина в ЖКТ в значительной степени зависит от активности транспортного белка энтероцитов гликопротеина Р. Биотрансформация сердечных гликозидов в печени определяется их полярностью — чем выше липофильность, тем активнее они подвергаются метаболизму (табл. 14-1). Биодоступность дигоксина равна 50-80%, ланатозида Ц — 15-45%. Наибольшим сродством к белкам плазмы крови обладают низкополярные препараты, наименьшим — полярные.
Для сердечных гликозидов характерен большой объём распределения (например, у дигоксина он равен 7 л/кг), т.е. они накапливаются в основном в тканях (главным образом в скелетных мышцах). Сердечные гликозиды плохо проникают в жировую ткань. Поэтому для пациентов с ожирением дозу препарата следует рассчитывать, исходя из идеальной, а не реальной массы тела. Приблизительно у 10% пациентов возможен кишечный метаболизм дигоксина под влиянием микрофлоры кишечника, что может быть причиной низкой концентрации препарата в плазме крови.
Таблица 14-1. Основные фармакокинетические параметры сердечных гликозидов
| Т!/2' Ч | Связывание с белками, % | Абсорбция, % | Действие | ||
| мнн | начало эффекта | максимум эффекта, ч | |||
| Дигоксин в/в внутрь | 30-40 30-40 | 20-40 20-40 | 30-80 | 5—30 мин 1,5-3 ч | 1-4 4-6 |
| Ланатозид Ц | 28-36 | 20-25 | 20-60 | 1,5-3 ч | 4-6 |
| Строфантин | 20-24 --------------- | <5 | 5—10 мин | 1,5-3 |
Инотропные лекарственные средства <!- 339
Показания и режим дозирования
Показания к применению сердечных гликозидов — сердечная недостаточность и мерцательная аритмия/трепетание предсердий. В некоторых случаях сердечные гликозиды применяют для профилактики реципрокной узловой предсердно-желудочковой тахикардии. Изучение патогенеза сердечной недостаточности, появление новых лекарственных препаратов, внедрение в клиническую практику принципов терапии, основанной на доказательной медицине, основательно изменили фармакотерапию сердечными гликозидами. • Сердечная недостаточность с синусовым ритмом и мерцательной аритмией. Создание ингибиторов АПФ изменило подходы к терапии, позволяя эффективно лечить пациентов с синусовым ритмом в тяжёлом состоянии без назначения сердечных гликозидов. Осторожность в отношении сердечных гликозидов определяли и результаты клинических испытаний препаратов с положительным инот-ропным действием. При сердечной недостаточности с мерцательной аритмией сердечные гликозиды продолжали оставаться препаратами выбора. В 1997 г. были опубликованы результаты крупного пла-цебо-контролируемого исследования, в котором дигоксин не оказывал никакого влияния на прогноз больных. Тем не менее, ослабляя симптомы сердечной недостаточности, дигоксин сохраняет своё значение в некоторых случаях заболевания с синусовым ритмом, например у пациентов с тяжёлым течением заболевания, несмотря на применение адекватных доз ингибиторов АПФ, диуретиков и р-адреноблокаторов. В настоящее время (З-адреноблокаторы начинают широко использовать при мерцательной аритмии и сердечной недостаточности (сочетают дигоксин с небольшими дозами метопролола, карведилола или бисопролола с их последующим постепенным увеличением, затем по мере снижения ЧСС дозу дигоксина уменьшают вплоть до полной отмены препарата). Для более быстрого достижения Css предусмотрен режим нагрузочной дозы (дигитализация) сердечного гликозида с переходом на поддерживающую дозу. По принципам клинической фармакологии дигитализация являлась обязательным этапом лечения сердечной недостаточности. В настоящее время дигитализацию используют редко в связи с невозможностью прогнозирования индивидуальной чувствительности пациента к препарату. Кроме того, новые подходы к терапии сердечными гликозидами (применение нитратов, ингибиторов АПФ, антагонистов рецепторов типа 2 ангиотензина II, добута-
 340 -S- Клиническая фармакология ♦ Часть II -Ф- Глава 14
340 -S- Клиническая фармакология ♦ Часть II -Ф- Глава 14
Инотропные лекарственные средства -О* 341
 мина, допамина) позволяют стабилизировать состояние больного без насыщения его сердечными гликозидами. Также необходимо учитывать наличие различных факторов риска гликозидной интоксикации при сердечной недостаточности (нарушение электролитного равновесия, приём препаратов, повышающих содержание сердечных гли-козидов в плазме крови, и др.). Дигитализацию иногда используют при тахисистолической форме мерцания/трепетания предсердий при отсутствии выраженных признаков сердечной недостаточности. Нагрузочную дозу дигоксина можно рассчитать по формуле:
мина, допамина) позволяют стабилизировать состояние больного без насыщения его сердечными гликозидами. Также необходимо учитывать наличие различных факторов риска гликозидной интоксикации при сердечной недостаточности (нарушение электролитного равновесия, приём препаратов, повышающих содержание сердечных гли-козидов в плазме крови, и др.). Дигитализацию иногда используют при тахисистолической форме мерцания/трепетания предсердий при отсутствии выраженных признаков сердечной недостаточности. Нагрузочную дозу дигоксина можно рассчитать по формуле:
,,, 1(7,0л/кг)х (идеальная масса тела) х(1,5 мкг/л)]
Нагрузочная доза = ■=-------- —------------------------- -——--------- '-±,
0,65
где 7,0 л/кг — объём распределения дигоксина;
идеальная масса тела — рассчитывают по номограмме для больных с ожирением (при кахексии учитывают реальную массу тела);
1,5 мкг/л — терапевтическая концентрация препарата в плазме крови;
0,65 — биодоступность дигоксина.
Нагрузочную дозу дигоксина при внутривенном введении рассчитывают по этой же формуле, но без показателя биодоступности.
Дигитализацию с применением нагрузочной дозы называют быстрой.
Режим дозирования ланатозида Ц детально не разработан, так как препарат назначают реже, чем дигоксин.
Нагрузочную дозу строфантина не рассчитывают, его применяют кратковременно.
Поддерживающая доза дигоксина равна 0,0625-0,5 мг/сут в зависимости от возраста пациента, функционального состояния почек, ЧСС, сопутствующей терапии, индивидуальной переносимости препарата. Для расчёта поддерживающей дозы сначала высчитывают клиренс дигоксина:
Сійигжсина = 1,02 X (ClKpeamum,J + 57 Мл/МШ,
где С\0игоксша — клиренс дигоксина;
1,02 х(С1крес1тиншш) — почечный клиренс дигоксина, рассчитанный с учётом клиренса креатинина;
57 мл/мин — печёночный клиренс дигоксина.
При сердечной недостаточности эта формула принимает следующий вид (с учётом сниженной почечной и печёночной перфузии):
анкета = 0,88 х (С1крмттит) + 23 мл/мин,
Полученное значение в мл/мин переводят в л/сут.
Клиренс креатинина может быть рассчитан по формуле Кокроф-
та-Гаулта:
(140- возраст)х {масса тела в кг)
креатиниш, {Концентрация креатинина в плазме)х 72 Для женщин полученное значение умножают на 0,85. Таким образом, можно рассчитать поддерживающую дозу дигоксина:
Поддерживающая доза = (аД"^"'"")х(С'"'"-"")ХТ,
где Сттмы — желаемая концентрация дигоксина в плазме крови (1-2 мкг/л);
т _ интервал дозирования (1 раз в сутки);
F — биодоступность (0,65).
В настоящее время лечение дигоксином сразу начинают с поддерживающей дозы, при этом Css достигается за 4-6 Т]/2 (медленная ди-гитализация).
Дата добавления: 2015-07-25; просмотров: 94 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| ИНГИБИТОРЫ 4 страница | | | Терапевтический лекарственный мониторинг |