
|
Читайте также: |
Экстракционно-фотометрический метод основан на сочетании экстракции определяемого вещества с его последующим фотометрическим определением. Этот метод применяют при анализе сложных смесей,
1) когда нужно определить малые количества одних веществ в присутствии больших количеств других,
2) при определении примесей в присутствии основных компонентов, а также в тех случаях,
3) когда непосредственное определение интересующего элемента в смеси связано с большими трудностями.
При экстракции малых количеств примесей происходит не только их выделение, но и концентрирование. Поэтому экстракционно-фотометрический метод приобретает особо важное значение в связи с определением малых количеств примесей в веществах высокой степени чистоты, широко применяемых в атомной и полупроводниковой технике. Экстракционно-фотометрические методы анализа являются высокочувствительными методами, они быстро развиваются и очень перспективны. Экстракция разнолигандных комплексов - одно из наиболее интенсивно развивающихся направлений в аналитической химии, при этом разнолигандные комплексы используют для прямого определения не только ионов металлов-комплексообразователей, но и анионов-реагентов (лигандов). Разнообразие лигандов при образовании смешанных экстрагируюшихся комплексных соединений значительно расширяет возможности в повышении чувствительности экстракционно-фотометрических методов анализа. В экстракционно-фотометрических методах для определения металлов применяют экстракционные системы различных типов, выбор которых зависит от химической природы определяемого компонента, состава растворенных веществ и условий проведения экстракции. Для количественной оценки экстракционного равновесия используют следующие характеристики:
-Константа распределения KD = [MRn]O/[MRn] отношение концентрации экстрагируемой формы вещества (MRn)O в opганической фазе к его концентрации в той же самой форме в водной фазе в условиях равновесия. Для каждого несмешивающегося с водой растворителя константа распределения является величиной постоянной, при нормальном давлении зависит только от температуры и ионной силы раствора. Если обе жидкие фазы являются насыщенными относительно твердой фазы и равновесие достигнуто, то константа распределения равна отношению растворимостей распределяющегося вещества в органической и водной фазах: KD=SO/S
-Коэффициент распределения DC=CMO/CM отношение общей аналитической концентрации вещества в органической фазе к его обшей аналитической концентрации в водной фазе в условиях равновесия. Поскольку общая аналитическая концентрация является суммой различных ионных форм, соотношение между которыми в водной фазе зависит от рН и концентрации комплексобразующих peaгентов, коэффициент распределения не является постоянной величиной, а зависит от условий эксперимента и константы распределения.
-Массовый коэффициент распределения Dm=QO/Q отношение количества распределяемого вещества (ммоль) в органической фазе к количеству этого же вещества в водной фазе в условиях равновесия. Из сопоставления выражений DC и Dm нетрудно заметить, что
DC=DmW/V; Dm=DCV/W
где V и W- объемы водной и органической фаз.
Если, как это часто бывает при экстракции V/W=r=l, то величины DC и Dm становятся тождественными. При оценке полноты экстракции из выражения массового коэффициента распределения можно найти молярную долю (или процент) вещества, оставшегося в водной фазе после однократной экстракции:
a= (Qисх-QO)/Qисх = Q/(QO+Q)=1/(Dm+1)
при d-кратной экстракции a = (1+Dm)-d
Вычитая из единицы часть вещества, оставшуюся после экстракции, получим степень (фактор) извлечения:
E = QO/Qисх=DC/(DC+W/V)=Dm/(1+Dm)
- Степень извлечения представляет собой долю или процент от исходного количества вещества в объеме W водной фазы, экстрагируемую объемом V органический фазы при заданных условиях. Если водный раствор обрабатывают d последовательными порциями экстрагента и каждый раз отношение объемов органической и водной фаз V/W=r, то степень извлечения составляет Ed=1-(rD+1)-d
Степень извлечения зависит от тех же факторов, что и коэффициент распределения, и кроме того, от отношения объемов органической и водной фаз.
-Фактор обогащения

отношение количеств двух разделяемых веществ в фазе экстрагента отнесенное к исходному отношению их количеств до разделения. Фактор обогащения представляет собою коэффициент, на который нужно умножить исходное отношение количеств двух разделяемых веществ, чтобы получить отношение этих количеств в органической фазе после разделения.
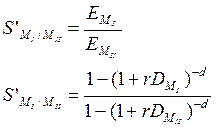
при d = 1, r = 1:
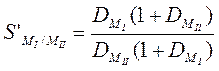
-Фактор разделения
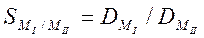 - отношение коэффициентов распределения двух разделяемых элементов MI и MII.
- отношение коэффициентов распределения двух разделяемых элементов MI и MII.
-Константа экстракции Кex – константа равновесия реакции экстракции.
РН1/2 - значение рН раствора, при котором 50% исходного количества вещества экстрагируется в органическую фазу.
Коэффициент распределения является наиболее распространенной характеристикой экстракционных процессов, особенно в условиях конкурирующих равновесий в водной фазе. Эта характеристика, зависящая от условий проведения экстракции и взаимосвязанная с константами распределения и экстракции, позволяет получить объективную количественную информацию в реальных условиях анализа. Во многих случаях коэффициенты распределения определяют экспериментально, однако при определенных условиях их можно прогнозировать и теоретически. Для этого необходимо знать состав экстрагирующихся соединений, их константы распределения и экстракции, а также иметь сведения о конкурирующих реакциях и образующихся соединенях в водном растворе.
Дата добавления: 2015-07-11; просмотров: 290 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Лекция 6 | | | СПЕКТР0Ф0Т0МЕТРИЧЕСК0Е ТИТРОВАНИЕ |