
|
Читайте также: |
Содержание
1. Фотометрический анализ
Классификация по приборному оформлению
2. Спектры поглощения
Закон Бугера-Ламберта-Бера
3. Связь спектров поглощения со строением молекул
4. Качественный анализ
5.Количественный анализ
Коэффициент экстинкции
1. Фотометрический, или молекулярный абсорбционный анализ – анализ по поглощению света молекулами анализируемого вещества и сложными ионами.
В фотометрическом анализе используется ближняя УФ, видимая и ближняя ИК области спектра электромагнитного излучения. В зависимости от степени монохроматичности света и связанного с ней приборного оформления различают:
1. Визуальную фотометрию – анализ проводится в полихромном излучении, охватывающем весь видимый диапазон спектра. Пример – определение рН с помощью индикаторной бумаги;
2. Фотоэлектроколориметрию – анализ проводится в полихромном излучении ближней УФ и видимой области спектра с выделением определенного участка из этого спектра с помощью светофильтров;
3. Спектрофотометрию - анализ проводится по поглощению монохроматического света в ближней УФ, видимой и ближней ИК областях спектра.
2. В фотометрическом анализе взаимодействие светового излучения сложными многоэлектронными системами описывают с помощью молекулярных спектров поглощения, вид которых определяется, в основном, состоянием электронов внешних орбиталей, участвующих в образовании химических связей. Электронные спектры поглощения представляют зависимости молярного коэффициента светопоглощения (e), оптической плотности (А) или пропускания (Т) от длины волны, частоты или волнового числа поглощаемого света. Соотношение между этими величинами задается формулами:
A = eCl = lg(I0/I)= 2-lgT.
Длина волны, при которой наблюдается максимальное поглощение света обозначается через lmax, а молярный коэффициент светопоглощения при этой длине волны emax. Положение максимума спектра поглощения является важной оптической характеристикой вещества, а характер и вид спектра поглощения позволяет проводить качественный анализ. При поглощении квантов света происходит увеличение внутренней энергии частицы, которая складывается из энергии вращения частицы как целого, энергии колебания атомов и движения электронов:
Е = Евр + Екол + Еэл
По энергии эти движения различают весьма существенно. Если Евр=1, то Екол = 102, Еэл = 103. Каждый вид энергии имеет квантовый характер и может быть охарактеризован определенным набором энергетических уровней.
Евр = 1,2 кДж/моль, что соответствует поглощению в далекой инфракрасной области спектра. Это соизмеримо с энергией теплового движения.
Екол до 60 кДж/моль, что соответствует фундаментальной и ближней ИК области спектра.
На этих видах спектров мы останавливаться не будем, так как они подробно изучались вами в курсе физики и строения вещества. Дальнейшее увеличение энергии излучения будет приводить к возбуждению электронных переходов, схема которых приведена на рис.
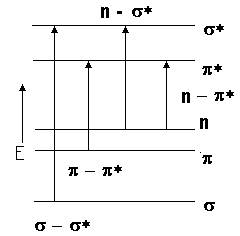
| где s - связывающие, n – несвязывающие p - разрыхляющие орбитали. Наибольшей энергии требует s ® s* переход. Он соответствует поглощению в |
далекой УФ области (l £ 200 нм, Е ³ 600 кДж/моль). Такие переходы присущи насыщенным углеводородам (связь С - С).
Переход n ® s* соответствует ближней УФ области (l = 200 -300 нм). Переходы на разрыхляющие орбитали n ® p* и p ® p* характерны для молекул с сопряженными связями, ароматических соединений. n ® p* переходом с несвязывающей орбитали кислорода объясняют окраску МnО4- и СrО42--ионов.
Введение в молекулу различных заместителей, или замена растворителя вызывает сдвиг полосы поглощения. Если полоса
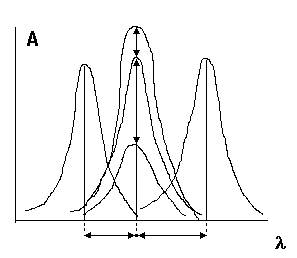
| поглощения смещается в сторону более длинных волн, говорят о батохромном (красном) смещении или углублении окраски, а |
если полоса поглощения сдвигается в сторону более коротких волн, говорят о гипсохромном эффекте (синем) смещении Увеличение интенсивности полосы поглощения называют гиперхромным эффектом, уменьшение - гипохромным.
3. Основные факты, позволяющие связать спектр поглощения (цвет) вещества с его строением, были установлены еще в XIX веке. В 1876 Витт пришел к заключению, что цветность органических соединений связана с присутствием в них определенных групп и связей, таких как азо
(-N=N-), виниленовой (-СН=СН-), азометиновой
(-СН=N-), нитро (NO2), нитрозо (-N=0), карбонильной (=С=0) и др. Эти группы Витт назвал хромофорами. Другие группы, которые в результате взаимодействия с хромофорами углубляют цвет соединения (приводят к батохромному смещению), а также придают им способность фиксироваться на тканях, он назвал ауксохромами. К ним относятся группы ОН, 0R, NH2, NHR, NR2 (где R - алифатический радикал – СН3, C2H5 и др.). Для установления связи между цветом и строением следует исследовать спектры не только в видимой, но и в более широкой облает Электронные спектры поглощения органических молекул расположены главным образом в области 200 - 1000 нм. Насыщенные органические молекулы (парафины, циклопарафины, эфиры и др.) не имеют избирательного поглощения в этой области. Учитывая это можно дать следующее определение хромофорной группы: хромофором называют группу атомов, которые при введении в насыщенный углеводород образуют соединения, имеющие избирательное поглощение в области 200 - 1000 нм. Хромофоры большей частью представляют собой группы с ненасыщенными связями. Однако соединения, содержащие связи типа С=С, С=N не сопряженные с другими ненасыщенными связями поглощают только в области спектра короче 200 нм. В таблице приведены примеры простых хромофоров
| Название хромофорной группы | Формула | Пример | l,нм | Растворитель |
| Карбонильная | RRC=O | ацетон | 270,6 | этанол |
| Карбонильная | RHC=O | ацетальдегид | 293,4 | этанол |
| Карбоксильная | -COOH | уксусная кислота | вода | |
| Амидная | -CONH2 | ацетамид | вода | |
| Этиленовая | RCH=CHR | этилен (пар) | ||
| Ацетиленовая | RCºCR | ацетилен (пар) | ||
| Азометиновая | =C=N | ацетоксим | вода | |
| Нитрильная | -C=N | ацетонитрил | вода | |
| Нитро | 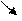 -N=O
O -N=O
O
| нитрометан | этанол |
Полоса поглощения хромофорной группы, как уже говорилось, может смещаться в зависимости от растворителя и соседних групп. Большей частью эти смещения не превосходят нескольких нм. Молекулы диенов, полиенов, ароматических соединений, a,b-ненасыщенных кетонов и др. представляют собой сопряженные системы простых хромофоров и образуют по существу новые хромофоры, т.к. изменение спектров поглощения таких систем по сравнению с исходными молекулами очень велико. Покажем это на примерах.:
С - С простая связь
Метан 125 нм, Этан 135 нм, н-октан 165 нм, циклопропан 189 нм. Спектры геометрических изомеров не различаются
Дифенилполиен С6Н5-(СН=СН)n- С6Н5
| Число этиленовых групп | |||||||
| l,нм |
В этом ряду e растет от 24000 до 135000. Видно, что увеличение lmax при введении следующей этиленовой группы образует сходящийся ряд. От I к 2 33 нм, от 6 к 7 уже 20 нм. Что касается интенсивности поглощения, то в зависимости от строения концевых групп возможен линейный рост, как в приведенном примере, или отклонения от него, например, в случае поливиниловых альдегидов Правда, в последнем случае отсутствуют сведения о чистоте исследованных веществ. Можно считать правилом, что смещение lmax вызванное концевой карбоксильной или эфирной группой эквивалентно смещению, которое происходит при введении одной этиленовой связи (около 21 нм) а смещение вызванное фенильным радикалом, равно 30,5 нм, СН3- 5 нм.
По окраске раствора можно визуально оценить область его поглощения:
| Цвет | lпогл, нм |
| Желто-зеленый | 400-435 |
| Желтый | 435-480 |
| Оранжевый | 480-500 |
| Красный | 490-500 |
| Пурпурный | 500-560 |
| Фиолетовый | 560-580 |
| Синий | 580-595 |
| Зеленовато-синий | 595-605 |
| Сине-зеленый | 605-750 |
Дата добавления: 2015-07-11; просмотров: 137 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Платиновые металлы. | | | Качественный анализ по электронным спектрам поглощения |