
Читайте также:
|
Для вычисления молярного коэффициента погашения комплекса циркония с теноилтрифторацетоном (ТТА) используют константу распределения этого комплекса между двумя растворителями. Мак Ви установил, что цирконий образует с ТТА комплекс в соотношении 1: 1 (если отсутствуют гидролиз и полимеризация) по уравнению: Zr4+ + HR D ZrR3+ + H+
Комплекс имеет максимум поглощения при 336 нм. Для вычисления молярного коэффициента погашения данного комплексного соединения при этой длине волны Цилен и Конник использовали две серии растворов:
Водные растворы, серия которых состоит из нескольких (например шести) пар растворов и в каждой паре концентрация ТТА одинакова, но цирконий содержит только один из растворов,
Водно-бензольные растворы. Двухфазная система состоит из таких же пар растворов, как и водная серия, но водная фаза во всех растворах приведена в равновесие с равным объемом бензольной фазы.
Предполагается, что поглощает только ТТА и комплекс ZrR3+. Тогда разность оптических плотностей двух растворов одной и той же пары водной серии будет равна:
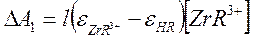 (1)
(1)
так как концентрация циркония намного больше концентрации реактива ТТА и, следовательно [ZrR3+] = [HR]исход
Уравнение (1) может быть записано для каждой пары растворов. Кроме того, для всех шести пар растворов отношение DА при l=366 нм к DА при любой другой длине волны будет величиной постоянной:
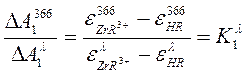 (2)
(2)
выражение для константы распределения KD реагента HR может быть записано:
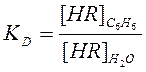 (3)
(3)
Так как [Zr4+]>>[TTA], то в водной фазе
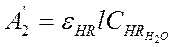 и
и 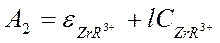 , но
, но
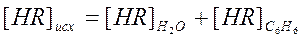
Учитывая (2) можно записать
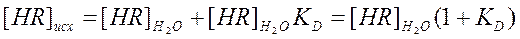 ,
,
откуда
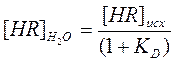 , но
, но 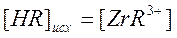 , следовательно
, следовательно
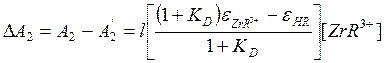 и для водной фазы имеем:
и для водной фазы имеем:
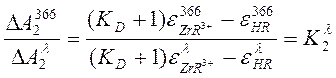 (4)
(4)
Совместным решением уравнений (2) и (4) получим 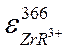 . Таким образом, для вычисления коэффициента молярного погашения по данному методу нужно знать коэффициент распределения реагента в системе бензол-вода, состав комплекса и уравнение реакции его образования. В аналитической практике часто не имеет значения какой величиной коэффициента экстинкции пользуются. Важно только быть уверенным, что коэффициент молярного погашения определен в том же концентрационном интервале, в котором находится анализируемая проба, и что в этом интервале выполняется закон Бугера-Ламберта-Бера, т.е., что эта величина постоянна. Если необходимо проводить анализ большого числа образцов, то удобно пользоваться методом калибровки или как его еще называют методом градуировки. Суть метода заключается в том, что для серии стандартных растворов с точно известными концентрациями, которые обычно готовятся разбавлением, измеряют величины оптической плотности и строят график зависимости оптической плотности растворов от их концентрации. Если эта зависимость линейна, закон Бугера-Ламберта-Бера выполняется, калибровка может быть выражена формулой линейной зависимости, рассчитываемой по методу наименьших квадратов из экспериментальных данных.
. Таким образом, для вычисления коэффициента молярного погашения по данному методу нужно знать коэффициент распределения реагента в системе бензол-вода, состав комплекса и уравнение реакции его образования. В аналитической практике часто не имеет значения какой величиной коэффициента экстинкции пользуются. Важно только быть уверенным, что коэффициент молярного погашения определен в том же концентрационном интервале, в котором находится анализируемая проба, и что в этом интервале выполняется закон Бугера-Ламберта-Бера, т.е., что эта величина постоянна. Если необходимо проводить анализ большого числа образцов, то удобно пользоваться методом калибровки или как его еще называют методом градуировки. Суть метода заключается в том, что для серии стандартных растворов с точно известными концентрациями, которые обычно готовятся разбавлением, измеряют величины оптической плотности и строят график зависимости оптической плотности растворов от их концентрации. Если эта зависимость линейна, закон Бугера-Ламберта-Бера выполняется, калибровка может быть выражена формулой линейной зависимости, рассчитываемой по методу наименьших квадратов из экспериментальных данных.
4. В отличие от других фотометрических методов, метод градуировочного графика позволяет определить концентрацию окрашенных растворов даже в тех случаях, когда основной закон светопоглощения не соблюдается. Для построения градуировочной кривой в этих случаях приготавливают значительно, большее число стандартных растворов, отличающихся друг от друга по концентрации не более чем на 10 %.
При построении градуировочного графика различают следующие варианты:
-График для чистых стандартных растворов, построенный при оптимальных условиях. Такие графики следует с осторожностью использовать для определений неизвестных концентраций в растворах, содержащих мешающие ионы, или в образцах различных матриц;
-График, построенный в присутствии отдельных мешающих компонентов матрицы, влияние которых достаточно подробно изучено;
-График, построенный по стандартным растворам, содержащим все посторонние элементы анализируемых объектов.
5. Метод добавок представляет собой разновидность метода сравнения. Определение концентрации этим методом основано на сравнении оптической плотности раствора до и после добавления известного количества определяемого вещества. Метод добавок обычно применяют для упрощения работы, для устранения мешающего влияния посторонних примесей, в ряде случаев для оценки правильности методики фотометрического определения. Этот метод позволяет создать одинаковые условия для фотометрирования исследуемого и стандартного (с добавкой) окрашенных растворов, поэтому его целесообразно применять для определения малых количеств различных элементов в присутствии больших количеств посторонних веществ при анализах солевых растворов. Неизвестную концентрацию находят расчетным или графическим способами. Рассмотрим их подробнее.
Пусть, оптическая плотность исследуемого раствора с концентрацией СХ равна Ах. После внесения добавки, концентрация определяемого компонента в которой равна СД, оптическая плотность раствора станет равна АХ+Д. Пусть, для анализа взята аликвота исследуемого раствора VX, к которой добавлено VД мл стандартного раствора. Тогда для обоих растворов можно записать:
АХ = eCXl (1)
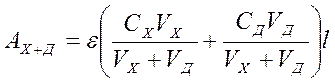 (2)
(2)
Разделим первое уравнение на второе:
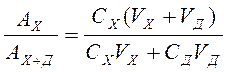 (3), откуда
(3), откуда
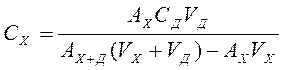
Добавки следует брать в таких количествах, чтобы не происходило "потери точности на вычитание". Минимальная разность АХ+Д-АХ должна быть не менее 0,1.
6. ОПРЕДЕЛЕНИЕ НЕИЗВЕСТНОЙ КОНЦЕНТРАЦИИ ГРАФИЧЕСКИМ СПОСОБОМ. При определении неизвестной концентрации графическим способом на оси ординат откладывают значение оптической плотности исследуемого раствора АХ, а на оси обсцисс из точек, отвечающих концентрациям добавки откладывают полученные после добавок величины оптических
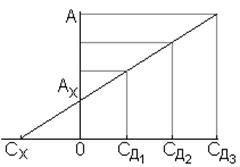
плотностей. Через полученные точки проводят прямую до пересечения с осью абсцисс и получают искомую концентрацию СХ. В одном из вариантов этого метода, к определенному объему раствора с неизвестной концентрацией добавляют такой же объем воды (точка СД = О, А = AХ), а к другим пробам такой же объем добавки с различными концентрациями определяемого компонента.
Наиболее распространенным способом определения концентрации фотометрическим методом является измерение завершенной цветной реакции, т.е., когда к моменту измерения оптической плотности сама реакция закончена. В фотометрических измерениях, используемых для медицинских диагностических целей такой способ определения концентрации получил название «конечной точки».
При определении концентрации веществ с использованием реакций, приводящих к образованию осадков такой подход неприменим, поскольку определяемое вещество осядет на дно кюветы и изменений оптической плотности практически не будет. В этом случае применяется способ, названный «фиксированное время». Оптическая плотность для каждой пробы измеряется дважды в ходе реакции: сразу после сливания реагентов (А1) и спустя определенное время (А2). Разность этих двух оптических плотностей и является мерой концентрации: С» (А2-А1)» DА
Построив зависимость DА от С для растворов стандартов с известными концентрациями определяемого компонента находят по ней концентрацию в исследуемом растворе. Еще более сложный случай возникает, когда необходимо определить активность фермента. В этом случае прибегают к способу определения, называемому «кинетика». Сущность кинетического измерения заключается в том, что в ходе реакции оптическая плотность измеряется многократно, а мерой активности фермента является скорость измерения оптической плотности раствора. При этом результат будет точным, если скорость изменения оптической плотности за время измерения остается постоянной, иными словами наблюдается близкая к линейной зависимость оптической плотности от времени измерения. Чаще всего измерения начинаются спустя минуту после сливания реактивов и продолжаются в течение трех минут. При этом получают значения оптических плотностей:
А0 – оптическая плотность реакционной смеси по истечении времени инкубации (лагфаза),
А1 – оптическая плотность реакционной смеси через 1 минуту после истечения лагфазы,
А2 – оптическая плотность реакционной смеси через 2 минуты после лагфазы,
А3 - оптическая плотность реакционной смеси через 3 минуты после лагфазы.
Рассчитанные величины скорости изменения оптической плотности DА/мин:
DА1 = А1 – А0; DА2 = А2 – А1; DА3 = А3 – А2
усредняются: 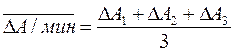
и мерой активности является средняя величина изменения оптической плотности за 1 минуту:
С» 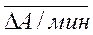 .
.
Как правило коэффициент пропорциональности между концентрацией и средней величиной изменения оптической плотности за 1 минуту известен (называется фактор), или может быть определен экспериментально по стандартным образцам.
Дата добавления: 2015-07-11; просмотров: 108 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Метод Юнгпена-Тонга и Кинга. | | | Лекция 5 |