
|
Читайте также: |
Тромболитические препараты. С момента первых клинических применений тромболитических препаратов при остром инфаркте миокарда (ОИМ) прошло более 40 лет [Fletcher et al., 1958]. Следует особо подчерк-
нуть вклад отечественной школы в развитие тромболитической терапии при ИМ. Е.И.Чазов, Г.В. Анд-реенко (1961), В.М.Панченко (1964), Л.И.Алейникова (1965) опубликовали результаты, указывающие, что введение тромболитического препарата фибринолизина больным ИМ уменьшает объем поражения миокарда, способствует более быстрой реставрации ЭКГ и уменьшает показатели смертности. В 1976 г. Е.И.Чазов и соавт. впервые в мире осуществили успешное введение фибринолизина в коронарную артерию при ИМ. Тем не менее только широкое использование коронароангиогра-фии при ОИМ [DeWood et al., 1980; Rentrop et al, 1979], а также морфологические работы Falk (1983), Da-vies (1983), убедительно показавшие, что причиной развивающегося инфаркта миокарда (ИМ) является внутрикоронарный тромбоз (ВКТ), возникающий, как правило, на месте имеющейся атеросклеротической бляшки с поврежденной поверхностью, способствовали организации двух крупных многоцентровых исследований, ставших классическими, так как именно с их помощью была доказана эффективность ТЛТ в отношении смертности при ИМ. Одно из них — GISSI (Gruppo Italiano per lo Studio della Streptochinasi ne nell'infarto miocardio) было выполнено в Италии и опубликовано в 1986 г., второе — ISIS-2 (Second International Study of Infarct Survival) было международным, и его результаты стали доступными в 1988 г. С начала 90-х годов ТЛТ вошла в перечень обязательных мероприятий при ОИМ.
Антитромботическая терапия при инфаркте миокарда должна быть направлена на скорейшее восстановление проходимости инфарктсвязанной артерии (ИСА), а также на борьбу с реокклюзией коронарной артерии. Для растворения тромба, окклюзиру-ющего артерию, используют тромболитические препараты, для поддержания проходимости коронарной
артерии различные классы анти-тромботических средств: препараты, ингибирующие функцию тромбоцитов, а также образование и инактивацию ключевого фермента свертывания — тромбина.
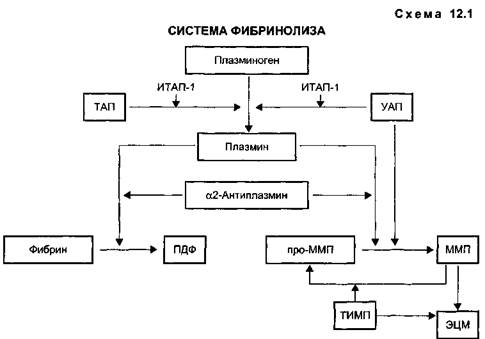
Основные компоненты системы фибринолиза представлены на схеме 12.1. Ключевой фермент фибринолиза — плазмин, расщепляющий фибрин до мелких фрагментов (ПДФ), образуется из неактивной протеазы плазминогена под действием активаторов плазминогена тканевого (ТАП) и урокиназного (УАП) типов. Современные тромболити-ческие препараты представляют собой активаторы плазминогена, способствующие переходу плазминогена в плазмин — активную протеазу, способную расщеплять фибрин до ПДФ, выводящихся из организма органами РЭС.
В настоящее время установлено, что эффективность тромболизиса зависит от быстроты его проведения по отношению к началу симптомов ИМ. Метаанализ 9 исследований,
выполненный в 1994 г. и включивший 58 600 больных, показал, что тромболизис, проведенный в первый час от начала ИМ, спасет 35 жизней, в первые 2—3 ч — 30 жизней, в первые 4—6 ч — 27 жизней и в первые 7—12 ч — 21 жизнь на 1000 пролеченных больных. Метаанализ Boers-ma (1996) продемонстрировал аналогичные тенденции — число спасенных жизней на 1000 пролеченных в первый час от начала ИМ составило 65, а при начале терапии в первые 7—12 ч всего 21. Таким образом, преимущества раннего тромболизиса безусловны, так как это способствует снижению смертности, а у 40 % обрывает процесс развития ИМ. Ранний тромболизис препятствует необратимому повреждению, развитию дисфункции миокарда и внезапной смерти, большая половина которой происходит в первые часы ИМ. Поэтому первый час от начала симптомов ИМ получил название "золотого" часа для проведения тромболизиса.
Эффективность тромболизиса в большей степени проявляется у на-
иболее тяжелых больных ИМ и возрастает пропорционально увеличению риска смерти. Так, количество спасенных жизней на 1000 пролеченных больных при САД < 100 мм Hg и частоте сердечных сокращений >100 ударов в минуту наибольшее — 62, при блокаде ножек пучка Гиса — 49, при переднем ИМ — 37, в то время как при нижнем ИМ — 8. При наличии сахарного диабета — 37, а при его отсутствии — 15.
При безусловном преимуществе раннего тромболизиса, поздний тромболизис, проведенный стрепто-киназой в первые 12—24 ч от начала симптомов ИМ, также способен уменьшить смертность за 5 нед наблюдения на 19 % (ISIS-2). По данным исследования LATE, при позднем тромболизисе тканевым активатором плазминогена смертность за 35 дней наблюдения снижается на 27 %. Среди возможных механизмов положительного влияния позднего тромболизиса рассматривают воздействие на электрическую стабильность миокарда, механизмы ремоде-лирования левого желудочка и возникновения аритмий.
Геморрагические осложнения являются краеугольным камнем тром-болитической терапии, их частота составляет в среднем около 0,7 %, из которых 0,4 % приходится на наиболее грозные — геморрагические инсульты. По мнению Simoons, у больного в возрасте старше 65 лет при массе тела менее 70 кг, артериальной гипертонии в анамнезе, а также при использовании тканевого активатора плазминогена в качестве тромболи-тика есть риск геморрагического инсульта.
Противопоказания к тромболизи-су разделяют на абсолютные и относительные. К первым относят инсульт, травму или большую операцию, перенесенные в предшествующие 3 нед, кровотечение из ЖКТ в предшествующий месяц, эпизоды геморрагического диатеза в анамнезе, расслаивающую аневризму. К относи-
тельным — преходящее нарушение мозгового кровообращения в предшествующие 6 мес, терапию непрямыми антикоагулянтами, беременность, пункцию крупных не компрессируемых сосудов, травмы после реанимации, рефрактерную артериальную гипертонию (САД > 189 мм рт.ст.) и недавно проведенную лазеротерапию сетчатки глаза.
Стрептокиназа и альтеплаза (тканевый активатор плазминогена) являются наиболее изученными и широко применяемыми тромболитиками. Стрептокиназа — белок, получаемый из b-гемолитического стрептококка группы С. Механизм действия стреп-токиназы состоит в образовании эк-вимолярного комплекса с плазмино-геном. После этого в результате внутренних превращений в молекуле плазминогена открывается активный центр и комплекс стрептокиназа— плазминоген приобретает способность активировать плазминоген в плазмин, который и фрагментирует фибрин тромба до ПДФ. Плазмин фрагментирует не только фибрин, но и фибриноген, циркулирующий в крови, чем и объясняется его снижение на фоне тромболизиса. Из-за антигенных свойств стрептокиназа может вызывать анафилактические реакции, частота которых составляет до 0,1 %. Стрептокиназу нельзя вводить повторно, начиная с 5-го дня от первой дозы и в течение 2 последующих лет.
Упомянутые выше исследования GISS1-1 и ISIS-2 установили, что внутривенное введение 1,5 млн ЕД стрептокиназы за 60 мин улучшает прогноз при ИМ. Исследование GISSI-1, включившее 12 000 больных в первые 12 ч ИМ, обнаружило снижение смертности на 18 %, а у больных с тромболизисом, проведенным в первый час от начала ИМ, на 47 %. Эффективность тромболизиса сохранялась в течение 1 года наблюдения и была доказана для больных с передним и распространенным ИМ, а также для лиц старше 65 лет.
В исследовании ISIS-2, включившим около 17 000 больных в первые 24 ч ИМ, снижение смертности в группе стрептокиназы составило 23 %.
Тканевый активатор плазминогена (ТАП) представляет собой фермент, синтезируемый эндотелием и способный превращать плазминоген в плазмин в присутствии фибрина. Активность ТАП зависит от фибрина, он имеет короткий период полужизни в плазме крови и регулируется специфическим ингибитором (ИТАП-1). Активация ТАП происходит на поверхности фибрина, при этом образующийся плазмин защищен от действия специфического ингибитора — а2-антиплазмина.
ТАП (альтеплаза, актилизе) — является в отличие от стрептокиназы фибрин-селективным препаратом, обладает способностью растворять устойчивые к лизису тромбы и не вызывает резкого снижения плазминогена. Кроме того, ТАП — физиологический активатор плазминогена и не обладает аллергенными свойствами. На введение ТАП не вырабатываются антитела, его можно вводить повторно. В отличие от стрептокиназы ТАП реже вызывает гипотонию и шок. Механизм действия ТАП условно можно разделить на три этапа: 1) ТАП связывается с плазминоге-ном, находящимся на фибрине, образуя тройной комплекс; 2) ТАП способствует проникновению плазминогена в фибрин, превращая плазминоген в плазмин; 3) образующийся плазмин расщепляет фибрин до ПДФ и тем самым разрушает тромб.
В исследовании ASSET (Anglo-Scandinavian Study of Early Thrombolysis) в 1988 г. было впервые показано, что применение ТАП в первые 5 ч у больных ОИМ снижает смертность по сравнению с плацебо на 26 %. В этом исследовании ТАП вводился в дозе 100 мг за 3 ч. После получения доказательств эффективности ТАП в отношении прогноза больных ИМ в сравнении с плацебо в
двух крупных исследованиях GISSI-2 (Gruppo Italiano per lo Studio della Sopravvivenza nell'Infarto miocardico) и IS1S-3 (Third International Study of Infarct Survival) была обнаружена одинаковая смертность при применении ТАП и стрептокиназы у больных ИМ. В дальнейшем в исследовании GUSTO-1 (Global Utilization of Streptokinase and t-PA for Occluded coronary arteries-1), включившем более 20 000 больных ОИМ, у ТАП по сравнению со стрептокиназой были обнаружены преимущества в отношении смертности, которая за 30 дней наблюдения соответственно составила 6,3 и 7,3 %, различия сохранялись в течение 1 года, наибольшие преимущества отмечались при переднем ИМ, у лиц старше 75 лет и при проведении тромболизиса в первые 2 ч от начала ИМ. Особенностью GUSTO-I в отличие от исследований GISSI-2 и ISIS-3 было "ускоренное" введение ТАП с одновременным применением гепарина. В настоящее время "ускоренный" режим введения ТАП считается оптимальным при начале лечения в первые 6 ч от начала ИМ. "Ускоренное" введение представляет собой внутривенное введение 100 мг актилизе за 90 мин, при этом введение препарата разбивается на три этапа: 1) 15 мг в виде болюса, 2) 50 мг — инфузия за 30 мин, 3) 35 мг — инфу-зия за 60 мин. Одновременно с ТАП назначается гепарин: 5000 ЕД болюсом до начала терапии ТАП, с последующей внутривенной инфузией со скоростью 1000 ЕД/ч на протяжении 48 ч.
Вторым общепризнанным критерием эффективности тромболити-ческого препарата является степень восстановления коронарного кровотока в инфарктсвязанной артерии (ИСА). В настоящее время для оценки степени восстановления коронарного кровотока пользуются классификацией TIMI (Thrombolysis in Myocardial Infarction), в соответствии с которой 0 и I степени восстановления кровотока соответствуют окклю-
зии ИСА, II и III степень восстановлению проходимости ИСА, среди которых оптимальной является III степень, характеризующая наличием нормального антеградного кровотока в сегменте, расположенном за стенозом.
В исследовании GUSTO было установлено, что чем лучше восстанавливается проходимость ИСА, тем благоприятнее прогноз больных ИМ. В этом же исследовании было показано, что "ускоренное" введение ТАП с одновременным назначением гепарина и аспирина имеет преимущества перед стрептокиназой в отношении проходимости ИСА. Третья степень восстановления кровотока по TIMI (нормальный антеградный кровоток) за 90 мин была отмечена у 54 % больных, получивших ТАП, против 30 % больных, получивших стрептокиназу; р < 0,0001. По частоте реокклюзий за 5—7 дней наблюдения группы не различались.
Пути повышения эффективности тромболитической терапии. Известно, что у 10—15 % больных ИМ тромбы в коронарных артериях устойчивы к действию тромболитиков, поэтому важным представляется поиск путей повышения эффективности тромбо-лизиса при ИМ. Помимо применения тромболизиса, на догоспитальном этапе с целью более раннего его начала перспективным представляется поиск новых тромболитических агентов. После определения структуры молекулы ТАП и изучения функции ее различных доменов поиск новых препаратов был связан с созданием рекомбинантных молекул ТАП с отсутствием определенных доменов или с созданием мутантных молекул. Рекомбинантный активатор плазминогена (ретеплаза) отличается от ТАП отсутствием в молекуле трех доменов: Крингла-1, домена EGF и домена связывания с фибронектином, что, по мнению создателей, обеспечивает препарату меньшее сродство к фибрину на поверхности тромба и большую возможность проникать
внутрь тромба. Кроме того, у ретеп-лазы больше, чем у ТАП, период полужизни, что позволяет ввести препарат быстрее и в меньшей дозировке.
Исследование GUSTO-III (The Global Use of Strategies To Open Occluded coronary arteries-III), включившее более 15 000 больных в первые 6 ч ИМ, было специально спланировано для сравнения эффективности альтеплазы (ТАП) и ретеплазы. В этом исследовании ретеплаза не обнаружила преимуществ перед аль-теплазой в отношении смертности за 30 дней наблюдения, которая соответственно составила 7,47 и 7,24 %; р=0,61. Никаких преимуществ ретеплазы не было обнаружено при отдельном рассмотрении больных в зависимости от локализации ИМ и начала терапии. В группе ретеплазы с началом терапии через 4—6 ч от появления симптомов ИМ отмечалась тенденция к увеличению смертности за 30 дней наблюдения — 9,7 % против 7,9 % в группе альтеплазы; р = 0,07. Таким образом, единственным преимуществом ретеплазы оказался способ ее введения в виде двух внутривенных болюсов по 10 ЕД с интервалом в 30 мин по сравнению с 90-минутной инфузией альтеплазы.
Тенектеплаза — мутантная форма ТАП с заменой трех аминокислот в различных доменах, приведшей к 8-кратному увеличению периода полужизни по сравнению с ТАП и увеличению специфичности к фибрину и устойчивости к естественному ингибитору тканевого активатора плазминогена (ИТАП-1); последняя у те-нектеплазы в 200 раз выше, чем у ТАП.
Сравнение эффективности тенек-теплазы с "золотым" стандартом тромболитической терапии — тканевым активатором плазминогена у больных ИМ проводилось в исследовании ASSENT-2 (The Assessment of the Safety and Efficacy of a New Thrombolytic Regimen-2), включившем почти 17 000 больных в первые
6 ч ОИМ. Тенектеплаза вводилась однократным болюсом в дозе 0,5 мг/кг за 5—10 с, альтеплаза по ускоренной схеме. Все больные получали аспирин и гепарин. По частоте первичной конечной точки, включавшей все случаи смерти за 30 дней, группы полностью совпали, кривые выживаемости тенектеплазы и аль-теплазы за 30 дней наблюдения практически наложились друг на друга. Таким образом, и в случае тенектеплазы единственным преимуществом, вопреки ожиданиям, по сравнению с альтеплазой оказалось удобство введения препарата.
Среди путей повышения эффективности тромболизиса важным представляется поиск оптимальных комбинаций тромболитиков с препаратами антитромбоцитарного действия, такими как аспирин, ингибиторы IIb/IIIа-рецепторов тромбоцитов, клопидогрель, а также с ингибиторами тромбина: гирудин, гирулог, ге-парины с низким молекулярным весом (ГНМВ).
После успешного тромболизиса и восстановления кровотока в коронарной артерии остается бляшка со скоплениями тромбоцитов на ее поверхности. Тромбоциты находятся в активированном состоянии (с экспонированными IIb/IIIа-рецепторами на поверхности) и создают условия для формирования ретромбоза. Поэтому идея "закрыть" активированные IIb/IIIа-рецепторы с помощью антител или ингибиторов другой природы представляется крайне привлекательной. Назначение антитромбоцитар-ных препаратов и ингибиторов тромбина одновременно с тромболитика-ми направлено прежде всего на ограничение роста тромба, а также на создание атромбогенной поверхности после растворения тромба с помощью тромболитического препарата.
Эффективность аспирина в лечении больных ОИМ доказана в исследовании ISIS-2 (1988). Монотерапия аспирином, начатая сразу же при подозрении на наличие у больного
ОИМ, на 23 % уменьшала показатели смертности, при этом риск развития геморрагических инсультов не увеличивался, а риск развития ише-мических инсультов даже снижался. Наиболее оптимальным было сочетание аспирина с тромболитиком, снижавшее показатели смертности по сравнению с группой плацебо на 42 %.
В 2001 г. были опубликованы результаты исследования GUSTO-V, в которое было включено 16 588 больных ИМ в первые 6 ч от начала болевого приступа. Все больные получали аспирин. Целью исследования было сравнение стандартной дозы ретеплазы, назначаемой вместе с НФГ (5000 ЕД болюсом с дальнейшей инфузией 1000 ЕД в час) и комбинации половинной дозы ретеплазы и абсиксимаба (РеоПро), назначенных вместе с НФГ в дозе 60 ЕД/кг. Разницы в показателях смертности за 30 дней наблюдения в группах ретеплазы и комбинации ретеплазы с абсиксимабом обнаружено не было, соответственно 5,9 и 5,6 %; р = НЗ. Однако частота рецидивов ИМ за 30 дней наблюдения была меньше в группе больных, получивших ретеплазу вместе с абсиксимабом, чем стандартную дозу ретеплазы, соответственно 2,3 и 3,5 %; р < 0,001. Более выраженных геморрагии было больше в группе больных, лечившихся ретеплазой в комбинации с абсиксимабом — 1,1 % против 0,5 % в группе больных, получивших стандартную дозу ретеплазы; р < 0,05.
Объединенный анализ исследований по изучению эффективности гепарина при ИМ, проведенных до появления доказательств эффективности тромболитических препаратов при ИМ, показал, что назначение гепарина при ИМ на 10—30 % уменьшает смертность, в особенности в отношении нарушений мозгового кровообращения, тромбоэмболии легочной артерии и других тромбоэмболичес-ких осложнений. Было также установлено, что назначение гепарина
44 - 4886
сопровождается увеличением риска нефатальных геморрагии. Однако эти исследования были выполнены в период широкого использования оральных антикоагулянтов в лечении ИМ, что не позволяет исключить их роли в возникновении геморрагии.
Ряд исследований (OSIRIS, ECSG-6) показал, что добавление гепарина улучшает проходимость ин-фарктсвязанной артерии (ИСА) после тромболизиса и немедленного назначения аспирина. Эти данные явились основанием для Американской ассоциации кардиологов, чтобы рекомендовать назначение гепарина больным ИМ. Имеются указания, что подкожное введение гепарина вместе со стрептокиназой предотвращает образование пристеночного тромбоза в левом желудочке. Однако однозначного ответа на вопрос — улучшает ли присоединение гепарина к терапии тромболитиком и аспирином показатели смертности от ИМ, пока не получено. Объединенный анализ двух крупных исследований GISSI-2 и ISIS-3 не обнаружил улучшения показателей смертности при присоединении гепарина к терапии тромболитиком и аспирином. Следует подчеркнуть, что в упомянутых исследованиях гепарин вводили подкожно, что, как известно, снижает его биодоступность. Однако в исследовании GUSTO-I при сравнении подкожного и внутривенного способов введения гепарина при ИМ в дополнение к тромболизису и терапии аспирином не было получено дополнительного положительного воздействия на показатели смертности за 35 дней наблюдения соответственно 7,2 и 7,4 %. При этом частота геморрагических инсультов и больших геморрагических осложнений увеличивалась (примерно 1 на 1000).
В рекомендациях Европейского общества кардиологов по лечению ИМ указано, что гепарин не способствует более быстрому лизису тромба, но при его назначении улучшается про-
ходимость ИСА. Несомненно также и то, что гепарин должен применяться в лечении ИМ при наличии у больного факторов риска тромбозов глубоких вен нижних конечностей и тромбоэмболии легочной артерии.
С появлением ГНМВ также связываются определенные надежды на улучшение исходов тромболитичес-кой терапии. В марте 2001 г. в Орландо на 50-й сессии Американского колледжа кардиологов были доложены результаты исследования AMI-SK, в которое было включено 496 больных в первые 12 ч от начала ИМ. Больные были рандомизированы в две группы: пациенты первой группы получали стандартную дозу стрепто-киназы, аспирин и эноксапарин (30 мг внутривенно болюсом, а затем 1 мг/кг 2 раза в день под кожу живота в течение 5 дней); больные второй группы вместо эноксапарина получали плацебо, т.е. фактически общепринятую схему тромболизиса стрептокиназой. В группе эноксапарина показатели, характеризующие степень восстановления проходимости ИСА, оказались лучше: 3-ю степень восстановления кровотока по классификации TIMI достигли 57,8 % больных в группе плацебо и 70,3 % в группе эноксапарина; р = 0,001. Суммарная частота смерти, повторного ИМ и рецидива стенокардии за 30 дней наблюдения соответственно составила 21 и 13,4 %. Частота серьезных геморрагии соответственно 2,8 и 4,8 %; р = 0,2.
Результаты исследования ASSENT-3 (The Assessment of the Safety and Efficacy of a New Thrombolytic Regi-men-3), опубликованные в августе 2001 г., подтвердили преимущества двух комбинаций: 1) стандартной дозы тенектеплазы с эноксапарином и 2) половинной дозы тенектеплазы с нефракционированным гепарином (доза, адаптированная к весу больного) и абсиксимабом (12-часовая ин-фузия) по сравнению с комбинацией стандартной дозы тенектеплазы и нефракционированным гепарином
в отношении суммарной частоты смерти, реинфаркта и рефрактерной ишемии за 30 дней наблюдения, которая соответственно составила 11,4; 11,1 и 15,4 %;р = 0,0001.
Проблема ретромбоза остается краеугольным камнем тромболизиса. Остающийся после тромболизиса пристеночный тромб с экспонированным на его поверхности тромбином продолжает стимулировать фибрино-образование, агрегацию тромбоцитов. Применение гепарина улучшает лишь показатели 90-минутной проходимости ИСА, при этом увеличивает частоту геморрагических осложнений. Гепарин слабо инактивирует связанный с фибрином тромбин и Ха-фактор, последний, находясь в составе протромбиназного комплекса, защищен от действия комплекса гепарин — AT III. Кроме того, естественный ингибитор гепарина — тромбоцитарный фактор 4, выделяющийся при реакции "освобождения" тромбоцитов, ингибирует гепарин в месте тромбообразования, а фибрин-мономер ингибирует активность комплекса гепарин — AT III. Все это заставило активно изучать эффективность прямых ингибиторов тромбина — гирудина, гирулога.
Первые пилотажные исследования по изучению применения гирудина при остром коронарном синдроме показали, что он вызывает более стабильную антикоагуляцию, чем гепарин, и что его комбинация с тром-болитиком и аспирином при ИМ предпочтительней в сравнении с гепарином в отношении проходимости ИСА, смертности, реинфарктов и развития тяжелой сердечной недостаточности в период госпитализации.
Сравнительное изучение эффективности гирудина и гепарина в качестве дополнительной терапии к тромболизису при ИМ проведено в исследовании TIMI 9B. Вопреки ожиданиям эффективность гирудина и гепарина в качестве дополнения к ТЛТ-терапии была одинаковой,
частота неблагоприятных событий за 30 дней наблюдения в группах гепарина и гирудина не различалась и соответственно составила 11,9 и 12,9 %. По частоте больших геморрагических осложнений группы также не различались, соответственно 5,3 и 4,6 %.
В 2001 г. на XXIII Европейском конгрессе кардиологов в Стокгольме были обнародованы результаты исследования HERO-2, целью которого было сравнить эффективность прямого ингибитора тромбина биви-лирудина (гирулога) с НФГ в комбинации со стрептокиназой у больных острым ИМ. В исследование было включено 17 073 больных, рандомизированных в соотношении 1:1 в группы НФГ (болюс + инфузия в течение 48 ч) и бивалирудина (болюс 0,25 мг/кг + инфузия в течение 36 ч). Результаты наблюдения за больными в течение 30 дней не выявили разницы в показателях смертности, которая составила в группе НФГ 10,9 % и в группе бивалирудина — 10,9; р = 0,876. Группа бивалирудина обнаружила преимущества перед группой НФГ только по частоте рецидива ИМ за 30 дней наблюдения, которая соответственно составила 2,8 и 3,6 %, ОР = 0,77, р = 0,004. Частота геморрагии также была больше в группе бивалирудина нежели в группе НФГ, соответственно тяжелых — 0,7 и 0,5 %, р = 0,08; умеренных — 1,4 и 1,0 %, р = 0,05; легких - 12,6 и 8,9 %, р < 0,001.
Снижение относительного риска реинфарктов на 33 % в группе бивалирудина не сказалось на показателях смертности за 30 дней наблюдения, возможно для обнаружения этого эффекта нужно наблюдение за больными в течение 1 года. Показатели смертности в HERO-2 оказались выше, чем в исследованиях ASSENT-3 и GUSTO-V. Среди возможных причин, объясняющих этот факт, следует учитывать, что в исследовании HERO-2 больные оказались старше, среди них было больше жен-
44*
щин и больше число инфарктов передней локализации, чаще встречалась сердечная недостаточность III и IV классов по Killip. В исследование HERO-2 включались больные из стран с разным уровнем развития медицины, в том числе 36 % больных из России, что также могло сказаться на результатах смертности, так как при отдельном анализе показателей смертности больных из западных стран она составила 6,7 %.
В группе бивалирудина оказалось больше геморрагии, но и активированное частичное тромбопластино-вое время (АЧТВ), характеризующее степень антикоагуляции, в группе бивалирудина оказалось в среднем на 40 % выше, чем в группе НФГ.
Тромболитическая терапия входит в перечень стандартных мероприятий при крупноочаговом ИМ. Считается, что при ее использовании в первые 6 ч от начала ИМ она спасает потенциально некротизированный миокард, улучшает функцию левого желудочка и, самое главное, снижает показатели смертности. Проблема резидуального стеноза после тромбо-литической терапии является чрезвычайно важной, так как частота реокклюзий ИСА в первые 2—3 нед после успешного тромболизиса составляет 8—12 %, а в течение 1 года наблюдения — 15—25 %.
Стрептокиназа и альтеплаза (тканевый активатор плазминогена) являются наиболее широко применяемыми тромболитиками, тем не менее имеются данные, указывающие на определенные преимущества альтеп-лазы перед стрептокиназой, заключающиеся в фибриноспецифичности альтеплазы, более быстром восстановлении проходимости ИСА и определенных преимуществах в отношении смертности, отсутствии аллергенных свойств, возможности повторно использовать препарат. Фактором, ограничивающим применение альтеплазы, является стоимость препарата, превышающая таковую у стрептоки-назы.
12.1.3. Антитромботическая терапия острого коронарного синдрома без стойкого подъема сегмента ST на ЭКГ (нестабильная стенокардия и инфаркт миокарда без зубца Q)
Антитромботическая терапия при ОКС без подъема сегмента ST патогенетически оправдана и ее эффективность доказана в крупных рандомизированных исследованиях. С точки зрения медицины, основанной на доказательствах, эффективность ацетилсалициловой кислоты (аспирина) в лечении ОКС без подъема ST изучена в наибольшей степени. Механизм действия аспирина связан с блокированием циклооксигеназы тромбоцитов, вследствие чего уменьшается синтез индукторов агрегации тромбоцитов: PGG2, PGH2 и тром-боксана А2 из арахидоновой кислоты (схема 12.2). Аспирин блокирует реакцию освобождения тромбоцитов, индуцированную АДФ и норадрена-лином и не влияет на адгезию тромбоцитов.
Эффективность аспирина в лечении больных НС впервые была продемонстрирована в трех исследованиях: Veterans Administration Cooperative Study, организованном в США в 1983 г., Канадском многоцентровом в 1985 г. и исследовании RISC, проведенном в Швеции в 1990 г. Использованные дозы аспирина составляли соответственно 324, 1300 и 75 мг в сутки, а период наблюдения 12, 18 и 3 мес. Назначение аспирина в сравнении с плацебо за год наблюдения на 30—48 % снижало риск развития ИМ и сердечно-сосудистой смерти.
В 1995 г. группа канадских исследователей (П.Теру и соавт.), проведя анализ больных НС, поступивших в БИТ, показали, что постоянный прием аспирина в дозе не менее 500 мг в неделю уменьшает тяжесть клинических проявлений острого коронарного синдрома. У больных, принимавших аспирин до поступления в клинику, ИМ был диагностирован
Дата добавления: 2015-10-21; просмотров: 156 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Патогенез | | | Схема 12.2 |