
|
Читайте также: |
5.1 Концентрация растворов
Растворы – это однородные (однофазные, гомогенные) системы переменного состава, образованные двумя или несколькими веществами (растворитель и растворенные вещества). Растворителем является то вещество, количество которого преобладает в данной системе. Растворяемое вещество может находиться в твердом (Т), жидком (Ж) и газообразном (Г) состояниях.
Растворы, в которых растворенное вещество находится в виде молекул, ионов или атомов и размер их не превышает 1 нм (1 нанометр=10-9 м), называют истинными растворами. Растворы солей, кислот, оснований и др. веществ в воде представляют собой истинные растворы. Состав раствора определяется количествами растворенного вещества и растворителя, его концентрацией.
Массовая доля (ω) показывает, какую часть от данной массы раствора (mр-ра) составляет масса растворенного вещества [m(В)]. Это безразмерная величина, которую можно выразить в долях единицы или в процентах

Если масса раствора определяется по его объему V (мл) и плотности ρ (г/мл), то:

Например, дан раствор с массовой долей гидроксида натрия (NaOH)=0,2 (т.е. 20 %), из чего следует, что каждые 100 г (кг) раствора содержат 20 г (кг) растворенного гидроксида натрия и 80 г (кг) воды.
Пример 1. Определите массовую долю (в %) хлорида калия в растворе, приготовленном из соли массой 12,70 г и воды массой 180,6 г.
Решение. Используя формулу, определяем массовую долю:

Пример 2. В воде объемом 400 мл растворили соль массой 60,0 г. Определите массовую долю (в %) соли в полученном растворе, если плотность воды равна 1,00 г/мл.
Решение. Определяем массу воды (растворителя):
m(Н2О) = V(H2O) · p(H2O) = 400 мл · 1,00г/мл = 400 г
Масса полученного раствора равна:
m(p-pa) = m(соли) + m(H2O) = 400 г + 60,0 г = 460 г
Рассчитываем массовую долю соли в растворе:

Пример 3. Рассчитайте, какую массу соли и воды необходимо взять для приготовления раствора массой 20 кг с массовой долей нитрата калия 15 %.
Решение. Рассчитаем, какая масса соли потребуется для приготовления раствора массой 20 кг.
 ;
;

Находим массу воды, необходимую для приготовления раствора:
m(H2O) = m(p-pa) – m(KNO3); m(H2O) = 20,0кг – 3,0кг = 17,0кг.
Пример 4. В воде массой 60 г растворили пентагидрат сульфата меди CuSO4·5H2O массой 5,0г. Определите массовую долю (в %) сульфата меди в полученном растворе.
Решение. Определяем массу безводного сульфата меди.
М(CuSO4·5H2O) = 160 + 90,0 = 250 г/моль
M(CuSO4) = 160 г/моль
250 г ¾ 160 г (CuSO4)
5,0 г ¾ х

Вычисляем массовую долю сульфата меди в полученном растворе

Пример 5. Раствор объемом 1,0 л, в котором массовая доля аммиака равна 28 % и плотность 0,9 г/мл, смешан с водой объемом 0,5 л. Рассчитайте массовую долю аммиака в полученном растворе, если плотность воды 1,0 г/мл.
Решение. Вычисляем массу аммиака, содержащуюся в растворе объемом 1,0 л (1000 мл):
 ,
,
где V (p-pa) – объем раствора аммиака, 1,0 л или 1000 мл;
ρ - плотность раствора аммиака.
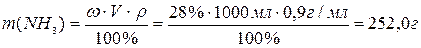 .
.
Масса полученного раствора равна:
m(p-pa NH3) + m(H2O) = V · ρ(p-pa NH3) + V · ρ(H2O) =
=1000 · 0,9 + 500 · 1,0 = 1400 г.
Определяем массовую долю аммиака в полученном растворе:
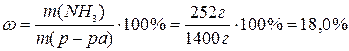 ,
,
Молярная концентрация [С(В)] - молярность - определяется количеством растворенного вещества (n), содержащегося в 1л раствора:
 ,
,
где V – объем раствора, л.
Единица измерения молярной концентрации – моль/л.
Молярность раствора обозначается буквой М (после числа). Например, раствор с молярной концентрацией хлорида натрия 1 моль/л может быть обозначен как 1М. Аналогично, записи 0,1М; 0,01М и 0,001М означают соответственно деци-, санти- и миллимолярный растворы.
Пример 6. Определите молярную концентрацию раствора, полученного при растворении гидроксида калия массой 16,80г в воде массой 183,2г, если плотность этого раствора равна 1,100г/мл.
Решение. Определяем массу полученного раствора:
m(p-pa) = m(KOH) + m(H2O)= 16,8 + 183,2=200,0 г.
Рассчитаем объем этого раствора:


Находим количество вещества гидроксида калия, используя формулу:
 ,
,
где m – масса гидроксида калия, г;
М – молярная масса КОН равная 56,0г/моль;
ν - 16,8 г/56,0г/моль = 0,30 моль.
Определяем молярную концентрацию раствора:
 .
.
Пример 7. Вычислите, какой объем раствора серной кислоты с массовой долей H2SO4 21,5% и плотностью 1,16г/мл потребуется для приготовления 10,0 л 0,60М раствора этой кислоты.
Решение. Определяем массу серной кислоты, которая должна содержаться в 10,0 л 0,60 М раствора:
 M(H2SO4) = 98,0 г/моль
M(H2SO4) = 98,0 г/моль
m(H2SO4) = C(H2SO4) · M(H2SO4) · V = 0,60 · 98,0 ·10,0 = 588 (г).
Находим массу раствора серной кислоты с массовой долей H2SO4 21,5 %, содержащую 588 г кислоты:
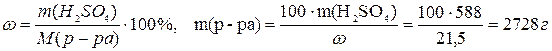
Рассчитываем необходимый объем раствора: 

Молярная концентрация эквивалента (нормальная концентрация)  определяется числом молей эквивалентов (νэ) растворенного вещества, содержащихся в 1л раствора
определяется числом молей эквивалентов (νэ) растворенного вещества, содержащихся в 1л раствора

где М(1/z B) – молярная масса эквивалента растворенного вещества, г/моль;
V – объем раствора, л.
Единица молярной концентрации эквивалента – моль/л.
Нормальная концентрация обозначается при написании н. (после числа). Например, раствор молярной концентрации эквивалента серной кислоты равной 1 моль/л может быть обозначен как 1н. Н2SО4.
Пример 8. Определите молярную концентрацию эквивалента раствора сульфата хрома (III), используемого в реакциях полного обмена, если в растворе объемом 400 мл растворено соли массой 7,84г.
Решение. Напишем уравнение реакции:
Cr2(SO4)3 + 6NaOH = 2Cr(OH)3 + 3Na2SO4

Рассчитываем молярную концентрацию эквивалента:
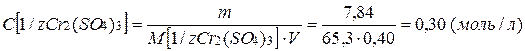
Задачи к разделу 5.1:
«Растворы. Способы выражения концентрации»
101 К раствору серной кислоты объемом 1,2 л и концентрацией 0,5 М прибавлено 2,4 л воды. Найдите нормальную концентрацию Н2SO4 в полученном растворе.
102 В воде массой 256 г растворили метиловый спирт объемом 82,2 мл и плотностью 0,81 г/мл. Определите молярную концентрацию полученного раствора, если его плотность равна 0,97 г/мл.
103 Определите массовую долю (%) хлорида кальция в растворе с концентрацией 1,45 М СаСl2 и плотностью 1,12 г/мл.
104 Вычислите, какой объем раствора с массовой долей серной кислоты 98,0 % и плотностью 1,84 г/мл потребуется для приготовления раствора с концентрацией 0,55 М объемом 100 мл.
105 К воде объемом 400 мл прилили раствор с концентрацией 2,00 М хлорида калия объемом 80,6 мл и плотностью 1,09 г/мл. Определите молярную концентрацию полученного раствора.
106 Определите молярную концентрацию раствора, полученного смешением 0,65 М раствора нитрата калия объемом 300 мл с 0,04М раствором этого вещества объемом 200 мл.
107 Вычислите нормальную концентрацию раствора серной кислоты, полученного при разбавлении 5,08 М раствора объемом 400 мл водой объемом 300 мл.
108 Определите нормальную концентрацию раствора сульфата хрома (III), если в растворе объемом 600 мл содержится Сr2(SO4)3 массой 40,6 г.
109 Определите, какая масса фосфорной кислоты содержится в растворе объемом 1,5 л, если нормальная концентрация равна 0,4 моль/л.
110 Вычислите массовую долю (%) серной кислоты в растворе, 1,00 л которого содержит 0,50 эквивалента Н2SO4, плотность раствора равна 1,03 г/мл.
111 Растворы одного и того же вещества молярной концентрации 0,4; 0,8 и 1,2 моль/л смешаны в объемных соотношениях 1,0:2,0:4,0. Определите молярную концентрацию полученного раствора.
112 Рассчитайте, какой объем раствора азотной кислоты с массовой долей HNO3 50,0 % и плотностью 1,32 г/мл необходимо взять для приготовления раствора объемом 2,00 л с концентрацией 0,69 моль/л.
113 Смешаны два раствора серной кислоты нормальной концентрации 0,2 и 1,2 моль/л, взятые объемом соответственно 2,5 и 1,5 л. Определите молярную и нормальную концентрации полученного раствора.
114 Вычислите объем воды, который необходимо прибавить к раствору сульфата калия объемом 100 мл для того, чтобы уменьшить его молярную концентрацию от 2,00 до 0,50 моль/л.
115 Определите молярную концентрацию раствора гидроксида натрия с массовой долей NaOH 30,0 % и плотностью 1,33 г/мл.
116 Рассчитайте, какой объем раствора с массовой долей гидроксида калия 16,0 % и плотностью 1,15 г/мл необходимо взять, чтобы приготовить раствор объемом 350 мл с молярной концетрацией КОН 1,20 моль/л.
117 Определите молярную концентрацию раствора, полученного смешением 0,45 М раствора нитрата серебра объемом 100 мл с 0,18 М раствором объемом 300 мл.
118 Найдите массовую долю серной кислоты в растворе, для которого нормальная концентрация равна 4,00 моль/л, а плотность 1,14 г/мл.
119 Растворы хлорида кальция нормальной концентрации 0,6 и 1,2 моль/л смешаны в объемном отношении 1:2. Вычислите молярную концентрацию полученного раствора.
120 Вычислите, какой объем раствора серной кислоты с массовой долей Н2SO4 90,0 % и плотностью 1,82 г/мл надо взять для приготовления раствора объемом 800 мл нормальной концентрации 0,25 моль/л.
5.2 Свойства растворов неэлектролитов
К общим (коллигативным) свойствам растворов неэлектролитов относятся:
· понижение давления насыщенного пара растворителя над раствором;
· понижение температуры замерзания (кристаллизации) растворов;
· повышение температуры кипения растворов;
· осмотическое давление.
5.2.1 Осмотическое давление
Самопроизвольный переход растворителя через полупроницаемую мембрану, разделяющую раствор и растворитель или два раствора с различной концентрацией растворенного вещества, называется осмосом. Количественно осмос характеризуется осмотическим давлением, равным силе, приходящейся на единицу площади поверхности мембраны. Осмотическое давление возрастает с увеличением концентрации растворенного вещества и температуры.
Вант-Гофф предполагал, что для осмотического давления можно применить уравнение состояния идеального газа.
p 

Откуда  ,
,
где p – осмотическое давление, кПа
с – молярная концентрация раствора, моль/л
ν – количество растворенного вещества, моль
V – объем раствора, л
R – молярная газовая постоянная, 8,31  .
.
Осмотическое давление разбавленного раствора численно равно тому давлению, которое производило бы данное количество растворенного вещества, занимая в виде газа при данной температуре объем, равный объему раствора.
Пример 1. Вычислите осмотическое давление раствора при температуре 22OC, в 1,2 л которого содержится 20,5 мг сахара С12Н22О11.
Решение. Вычисляем молярную концентрацию раствора

M(С12Н22О11)=342 г/моль; T=273+22=295 К.
Отсюда p=сRT=5×10-5×8,31×295=0,122 (кПа)=122 (Па).
Пример 2. В 250 мл раствора содержится 17 мг растворенного вещества. Осмотическое давление раствора при температуре 27oC равно 1,84 кПа. Вычислите молярную массу вещества.
Решение. Из формулы Вант-Гоффа выведем величину М и подставляем данные условия задачи:
 ; T=273+27=300К.
; T=273+27=300К.
Отсюда 
5.2.2 Давление пара растворителя над разбавленными растворами
неэлектролитов
Давление пара растворителя над раствором ниже давления его пара над чистым растворителем при той же температуре. Согласно закону Рауля понижение давления насыщенного пара растворителя А над раствором DPА пропорционально молярной доле растворенного нелетучего вещества В.
Если Рo – давление насыщенного пара растворителя над чистым раство- рителем,
Р – давление насыщенного пара растворителя над раствором,
Ро – Р =DP – понижение давления насыщенного пара растворителя,
νВ – количество растворенного вещества, моль,
νА – количество растворителя, моль,
cВ=  - молярная доля растворенного вещества,
- молярная доля растворенного вещества,
тогда 
Закон Рауля может быть выражен формулой
 , если c - молярная доля растворителя.
, если c - молярная доля растворителя.
Пример 3. Рассчитайте давление насыщенного пара бензола С6Н6 над раствором нафталина С10Н8 в бензоле при температуре 40оС, если в 400 г раствора содержится 128 г нафталина, а давление насыщенного пара чистого бензола при данной температуре равно 24,15 кПа.
Решение. Для решения задачи следует применить закон Рауля в виде
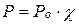 , вычислив молярную долю бензола.
, вычислив молярную долю бензола.
М(С6Н6) = 78 г/моль
М(С10Н8) = 128 г/моль
m(С6Н6) = 400 - 128 = 272 (г).
ν(С6Н6)=  (моль)
(моль)
ν(С10Н8)=  (моль)
(моль)
c(С6Н6)= 
Отсюда
 (кПа).
(кПа).
5.2.3 Температуры кипения и кристаллизации разбавленных растворов неэлектролитов
Растворы кипят при температуре более высокой, чем чистые растворители.
Следствие из закона Рауля: повышение температуры кипения DТкип пропорционально моляльной концентрации раствора Сm.
 ,
,
где Кэ – эбулиоскопическая постоянная растворителя.
Для воды Кэ = 0,52 

Растворы замерзают (из раствора кристаллизуется растворитель) при температуре более низкой, чем чистый растворитель.
Из закона Рауля: понижение температуры замерзания (кристаллизации) раствора DТзам пропорционально моляльной концентрации раствора Сm.
 ,
,
где Ккр – криоскопическая постоянная растворителя.
Для воды Ккр=1,85 
Пример 4. Вычислите температуру кипения Ткип и температуру замерзания Тзам водного раствора глицерина С3Н8О3 с массовой долей 15%.
Решение.
Кэ= 0,52, Ккр = 1,86, M(С3Н8О3) = 92 г/моль.
Вычислим моляльную концентрацию раствора.
По условию масса глицерина m=15г.
масса воды m(Н2О)=100-15=85г=0,085кг.

Согласно следствию из закона Рауля
DТкип = Кэ × Сm= 0,52 × 1,92 = 1,00
Ткип = 100 + 1,0 = 101оС
DТзам = Ккр × Сm = 1,86 × 1,92 = 3,57
Тзам= 0 - 3,57= - 3,57оС
Задачи к разделу 5.2:
«Свойства растворов неэлектролитов»
121 Вычислить, сколько граммов глюкозы С6Н12О6 содержится в 200 мл раствора, осмотическое давление которого при температуре 37оС составляет 810,4 кПа.
122 Осмотическое давление раствора, в 250 мл которого содержится 2,3 г растворенного неэлектролита, при температуре 27оС равно 249 кПа. Вычислите молярную массу растворенного вещества.
123 Определите, какова масса растворенного в 1,5 л раствора анилина С6Н5NH2, если осмотическое давление такого раствора при температуре 17оС равно 193 кПа.
124 Найдите молярную массу неэлектролита, если при растворении 28 г вещества при температуре 27оС осмотическое давление составило 700 кПа.
125 Осмотическое давление некоторого раствора при температуре - 3оС составляет 2735 кПа. При какой температуре осмотическое давление достигнет 3040 кПа?
126 При температуре 315К давление насыщенного пара над водой равно 82 кПа. Насколько понизится давление насыщенного водяного пара при указанной температуре, если в 540 г воды растворить 36 г глюкозы С6Н12О6? Чему равно осмотическое давление такого раствора, если плотность его 1,01 г/мл?
127 Давление пара воды при температуре 25оС составляет 3167 Па. Вычислите для той же температуры давление пара раствора, в 450 г которого содержится 90 г глюкозы С6Н12О6.
128 Давление пара воды при температуре 20оС составляет 2338 Па. Сколько граммов сахара С12Н22О11 следует растворить в 720 г воды для получения раствора, давление пара которого на 18,7 Па меньше давления пара воды? Вычислите массовую долю сахара в растворе.
129 Давление пара воды при температуре 10оС составляет 1228 Па. В каком количестве воды следует растворить 23 г глицерина С3Н8О3 для получения раствора, давление пара которого составляет 1200 Па при той же температуре? Вычислите массовую долю глицерина в растворе.
130 При температуре 32оС давление пара водного раствора некоторого неэлектролита составляет 4721 па, а давление пара воды при той же температуре 4753 Па. Вычислите осмотическое давление раствора при той же температуре, приняв плотность раствора равной единице.
131 Температура кристаллизации бензола 5,5оС, а раствор 6,15 г нитробензола в 400 г бензола кристаллизуется при температуре 4,86оС. Криоскопическая константа бензола 5,12. Вычислите молярную массу нитробензола.
132 При растворении 0,4 г некоторого вещества в 10 г воды температура кристаллизации раствора понижается на 1,24оС. Вычислите молярную массу растворенного вещества.
133 В каком количестве воды следует растворить 0,5 кг глицерина С3Н8О3 для получения раствора с температурой кристаллизации равной -3оС?
134 Раствор сахара С12Н22О11 оказывает при температуре 27оС осмотическое давление, равное 156 кПа. Принимая плотность раствора равной единице, вычислите температуру его кристаллизации.
135 Рассчитайте, чему равна молярная масса растворенного в 500 г бензола неэлектролита массой 76,1 г, если Тзам понизилась с температуры 5,4оС до 0,3оС? Ккр(бензола)=5,1.
136 Какую массу глицерина С3Н5(ОН)3 нужно растворить в 500 г воды, чтобы повысить Ткип на 1,5К?
137 Температура кипения разбавленного раствора сахара С12Н22О11 100,065оС. Вычислите осмотическое давление раствора при температуре 0оС. Плотность раствора принять равной единице.
138 Температура кипения эфира 34,6оС, а его эбуллиоскопическая константа равна 2,16. Вычислите молекулярную массу бензойной кислоты, если известно, что 5%-ный (по массе) раствор этой кислоты в эфире кипит при температуре 35,53оС.
139 Температура кипения ацетона 56,1оС, а его эбуллиоскопическая константа равна 1,73. Вычислите температуру кипения 8%-ного (по массе) раствора глицерина С3Н8О3 в ацетоне.
140 Раствор, содержащий 5,4 г вещества–неэлектролита в 200 г воды, кипит при температуре 100,078оС. Вычислите молекулярную массу растворенного вещества.
5.3 Свойства растворов электролитов
При взаимодействии растворенного вещества с растворителем (водой) может происходить распад молекул на ионы.
Процесс распада молекул веществ на положительно заряженные ионы-катионы и отрицательно заряженные – анионы под действием растворителя называют электролитической диссоциацией (Аррениус, 1887). Процесс электролитической диссоциации можно представить уравнениями:
Cr2(SO4)3 = 2Cr3+ + 3SO42-
HCl = H+ + Cl-
KOH = K+ + OH-
Количественная оценка процесса электролитической диссоциации определяется двумя величинами: степенью диссоциации (a) и константой диссоциации (Кд).
5.3.1 Степень диссоциации
Степень диссоциации (a) – это величина, показывающая, какая часть растворенных молекул электролита распалась на ионы:
 a = n / N = C(B)д / С(В),
a = n / N = C(B)д / С(В),
где: n – число молекул, распавшихся на ионы;
N – общее число молекул растворенного вещества в растворе;
С(В)д–молярная концентрация продиссоциировавшего электролита, моль/л;
С(В)-молярная концентрация электролита в растворе, моль/л.
Например, концентрация [С(В)] растворенного вещества 0,2 моль/л, а концентрация диссоцированной части [С(В)д] равна 0,001 моль/л, то для данного вещества a=0,001/0,2=0,005 или 0,5 %.
Степень электролитической диссоциации изменяется в пределах от 0 до 1 и может быть выражена в долях единицы или в процентах.
В зависимости от степени диссоциации при одинаковой концентрации и температуре электролиты условно делятся на сильные и слабые.
Сильные электролиты диссоциированы полностью, т.е. степень их диссоциации равна единице
HNO3 = H+ + NO3-.
Сильными электролитами являются соли, некоторые кислоты и основания. Например, к сильным кислотам можно отнести: HCl, H2SO4, HNO3, HClO4, а сильными основаниями являются: NaOH, KOH, RbOH, CsOH, Ba(OH)2. К слабым электролитам относятся соединения: HCOOH, HNO2, H2S, H2SO3, H2CO3, CH3COOH, H3РO4, HF, HCN, NH4OH и др.
5.3.2 Константа диссоциации
Слабые электролиты диссоциированы частично, значительная часть его находится в недиссоциированном состоянии. В растворе слабых электролитов (a≤1) устанавливается равновесие между ионами и недиссоциированными молекулами электролита, которое можно охарактеризовать константой диссоциации (Кд). Например, для раствора циановодородной кислоты можно написать уравнение
HCN ↔ H+ + CN-

где [Н+] = [CN-] - молярная концентрация ионов в растворе, моль/л;
[HCN] - молярная концентрация недиссоциированных молекул, моль/л.
Константа диссоциации электролита – величина постоянная при данной температуре и не зависит от концентрации.
В рассматриваемом примере [Н+] = [CN-], поэтому
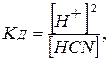 откуда
откуда  .
.
Степень диссоциации (a), константа диссоциации (Кд) и концентрация раствора [С(В)] связаны между собой законом разбавления Оствальда (1888), который выражается уравнением
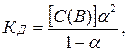
При малых значениях степени диссоциации разность 1-a можно принять за единицу, тогда Кд = С(В) × a2 и 
Из упрощенного уравнения закона разбавления вытекает, что с уменьшением концентрации раствора слабого электролита степень его диссоциации возрастает.
Пример 1. Определите степень диссоциации уксусной кислоты, молярная концентрация которой в растворе равна 0,1 моль/л при 200С, Кд(СН3СООН) = 1,8×10-5.
Решение. Кислота диссоциирует
СН3СООН «Н+ + СН3СОО-
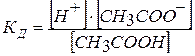
Из закона разбавления Оствальда следует:

или 0,013×100 % = 1,3 %.
5.3.3 Ионное произведение воды. Водородный показатель
Молекулы воды полярные и при их электростатическом взаимодействии в чистой воде происходит диссоциация, которую можно представить уравнениями:
2H2O «H3O+ + OH−
или в упрощенном виде:
Н2О «Н+ + ОН−

Как показывает величина константы диссоциации, вода является слабым электролитом, для нее можно считать концентрацию недисоциированных молекул равной общей концентрации воды. Для воды объемом 1л концентрация будет равна 1000 г /18 г/моль = 55,6 моль/л. Тогда Кд = [Н2О] = [Н+]×[ОН-], [Н+]×[ОН-] = 55,6×1,8×10-16 = 10-14.
Величина [Н+]×[О-] = 10-14 = Кв называется ионным произведением воды. Так как в воде концентрации ионов водорода и гидроксид-ионов равны, то

Концентрация ионов водорода в растворе может служить мерой кислотности или щелочности среды. Если [Н+] > 10-7 моль/л – среда кислая, в щелочных растворах [Н+] < 10-7 моль/л.
Для определения характера среды более удобной величиной является водородный показатель рН, который представляет отрицательный десятичный логарифм концентрации ионов водорода:
рН = -lg[H+].
Для нейтральных растворов рН=7, для кислых – меньше 7, щелочных– больше 7.
Если выражение [Н+] ×[ОН-] = 10-14 прологарифмировать и поменять знаки на обратные, то получим рН + рОН = 14, где рОН - гидроксидный показатель.
Пример 2. Определите рН раствора хлороводородной кислоты, молярная концентрация которого равна 0,01 моль/л.
Решение. Сильные кислоты в водных растворах диссоциируют полностью:
HCl = H+ + Cl-,
поэтому [Н+] = С(НСl) = 0,01 моль/л.
рН = - lg[Н+] = - lg ·10-2; рН = 2.
Пример 3. Вычислите рН раствора, массовая доля муравьиной кислоты в котором равна 2 %, а плотность раствора принять равной единице. Кд(НСООН) = 1,8·10-4.
Решение. Муравьиная кислота - слабый электролит.
НСООН ↔ Н+ + НСОО-
 .
.
Рассчитываем молярную концентрацию раствора кислоты:
С(В) = 
где М(НСООН) = 46 г/моль.
Используя выражение константы диссоциации, находим концентрацию ионов водорода:
 Определяем водородный показатель:
Определяем водородный показатель:
рН = - lg[Н+] = - lg 8,8×10-3 = 2,06.
Пример 4. Вычислите концентрацию ионов водорода и гидроксид-ионов в растворе, рН которого равен 5.
Решение. рН = −lg [Н+] = 5. Концетрация [Н+] = 10-5 моль/л.
Исходя из ионного произведения воды [Н+]×[ОН-]=10-14, находим концентрацию гидроксид-ионов:

Задачи к разделу 5.3:
«Свойства растворов электролитов»
141 Вычислите рН раствора, молярная концентрация NH4OH в котором равна 0,02 моль/л. Кд(NH4OH)=1.8×10-5.
142 Рассчитайте рН раствора, массовая доля уксусной кислоты СН3СООН в котором равна 5 %. Плотность раствора примите равной 1г/мл, Кд(СН3СООН)=1,8×10-5.
143 Определите рН раствора муравьиной кислоты, массовая доля НСООН в котором равна 6 %. Плотность раствора примите равной 1 г/мл, Кд(НСООН)=1,8×10-4.
144 Рассчитайте концентрацию хлорноватистой кислоты, если рН раствора равен 2. Кд(НСlO)=5×10-8.
145 Вычислите молярную концентрацию циановодородной кислоты HCN, если рН раствора равен 3. Кд(HCN)=7,2×10-10.
146 Определите концентрацию гидроксида калия в растворе, рН которого равен 9. Степень диссоциации гидроксида калия примите равной единице.
147 Определите молярную концентрацию азотистой кислоты HNO2 в растворе, рН которого равен 2. Кд(HNO2)=5,1×10-4.
148 Вычислите рН раствора с массовой долей гидроксида аммония NH4OH 8%. Плотность раствора примите равной единице. Кд(NH4OH)=1,8×10-5.
149 Определите молярную концентрацию уксусной кислоты СН3СООН в растворе, рН которого равен 3. Кд(СН3СООН)=1,8×10-5.
150 Раствор объемом 1,0 л содержит гидроксид натрия массой 0,6 г. Определите рН этого раствора. Степень диссоциации гидроксида натрия примите равной единице.
151 Найдите концентрацию ионов водорода и рН раствора, в котором массовая доля хлороводородной кислоты составляет 0,005 %. Степень диссоциации кислоты и плотность раствора принять равными единице.
152 Вычислите водородный показатель рН раствора, в котором концентрация гидроксида калия КОН 0,006 моль/л. Степень диссоциации гидроксида и плотность раствора примите равной единице.
153 Вычислите рН раствора с концентрацией уксусной кислоты СН3СООН 0,01М, в котором степень диссоциации кислоты равна 0,04.
154 Степень диссоциации слабой одноосновной кислоты в растворе с концентрацией 0,20 М равна 0,05. Вычислите концентрацию ионов водорода, гидроксид-ионов и рН этого раствора.
155 Вычислите рН раствора, концентрация гидроксида аммония NH4OH в котором равна 0,04 моль/л. Кд(NH4OH)=1,8×10-5.
156 Определите рН раствора с массовой долей азотной кислоты HNO3 5%. Степень диссоциации и плотность раствора принять равными единице.
157 Вычислите рН раствора гидроксида натрия, массовая доля NaOH в котором равна 1%. Степень диссоциации NaOH и плотность раствора примите равными единице.
158 Вычислите рН раствора, массовая доля хлороводородной кислоты HCl в котором равна 0,05 %. Степень диссоциации и плотность раствора принять равными единице.
159 Определите концентрацию ионов водорода и рН раствора циановодородной кислоты HCN, молярная концентрация которой равна 0,2 моль/л. Кд(HCN)=7,2×10-10.
160 Вычислите концентрацию ионов водорода и рН раствора, если концентрация гидроксид-ионов ОН- в растворе равна 0,03 моль/л.
5.4 Реакции ионного обмена
Реакции ионного обмена. В водных растворах электролиты в большей или меньшей степени находятся в виде ионов. При смешивании растворов различных веществ находящиеся в них ионы противоположного знака могут взаимодействовать, образуя молекулы нового вещества. Реакции, протекающие между ионами и не сопровождающиеся изменением заряда частиц, называют реакциями ионного обмена. Эти реакции протекают в направлении образования:
- малорастворимых соединений,
- слабодиссоциирующих веществ,
- газообразных веществ.
Сущность обменных реакций выражается написанием ионно-молекулярного уравнения. При этом необходимо учитывать, что сильные электролиты находятся в растворе в виде ионов, а слабодиссоциирующие, малорастворимые соединения и газы – в молекулярной форме, независимо от того, являются они исходными реагентами или продуктами реакции. Например,
AgNO3 + NaCl ® AgCl¯ + NaNO3
Ag+ + Cl- = AgCl¯
FeS + 2HCl = FeCl2 + H2S
FeS + 2H+ = Fe2+ + H2S
KCN + HCl = HCN + KCl
CN- + H+ = HCN
Задачи к разделу 5.4
«Реакции ионного обмена»
161 Напишите в молекулярной и ионно-молекулярной формах уравнения реакций взаимодействия веществ: а) хлорида бария и сульфата калия; б) нитрата серебра и хлорида калия.
162 Смешивают попарно растворы: а) нитрата меди и гидроксида кальция; б) сульфита калия и хлороводорода. Пойдут ли реакции до конца? Напишите для этих реакций молекулярные и ионно-молекулярные уравнения.
163 Напишите в молекулярной и ионно-молекулярной формах реакции взаимодействия между:
а) гидроксидом хрома и серной кислотой;
б) гидроксидом хрома и гидроксидом натрия.
164 Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия между:
а) карбонатом кальция и хлороводородной кислотой;
б) сульфатом натрия и нитратом бария.
165 Смешивают попарно водные растворы
а) гидроксида кальция и серной кислоты;
б) ацетата натрия и азотной кислоты.
Для реакций, протекающих практически до конца, составьте молекулярные и ионно-молекулярные уравнения реакции.
166 Напишите в молекулярной и ионно-молекулярной формах уравнения реакций взаимодействия между: а) ацетатом калия и серной кислотой; б) сульфидом натрия и хлоридом железа (II).
167 Напишите молекулярные и ионно-молекулярные уравнения следующих ре акций:
а) AgNO3 + K2CrO4 ®
б) Cr2(SO4)3 + KOH ®
168 Напишите молекулярные и ионно-молекулярные уравнения следующих реакций:
а) FeS + HCl ®
б) HCN + NaOH ®
169 Составьте в молекулярной и ионно-молекулярной формах уравнения реакций взаимодействия между: а) карбонатом кальция и хлорводородной кислотой; б) хлоридом аммония и гидроксидом калия.
170 Напишите в молекулярной и ионно-молекулярной формах уравнения реакций взаимодействия между: а) гидроксидом хрома (III) и гидроксидом натрия; б) цианидом натрия и азотной кислотой.
171 Укажите, можно ли приготовить раствор, содержащий одновременно следующие пары растворенных веществ: а) цианид калия и серная кислота; б) сульфат аммония и гидроксид калия. Напишите возможные реакции в молекулярном и ионно- молекулярном виде.
172 Напишите в молекулярном и ионно-молекулярном виде уравнения реакций взаимодействия следующих веществ:
а) NH4Cl + Ca(OH)2 ®
б) H2SO4 + NaOH ®
173 Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия между:
а) гидроксидом бария и азотной кислотой;
б) сульфатом стронция и нитратом бария.
174 Укажите, можно ли приготовить раствор, содержащий одновременно следующие пары растворенных веществ:
а) фосфорная кислота и нитрат кальция;
б) хлорид бария и сульфат хрома.
В случае протекания реакций составьте молекулярные и ионно-молекулярные реакции.
175 К каждому из ионно-молекулярных уравнений составьте по два уравнения реакции в молекулярной форме:
а) Ba 2+ + SО42- = BaSО4¯
б) CО32- + 2H += CО2 + H2O.
176 Составьте по два молекулярных уравнения к каждому из ионно-молекулярных уравнений:
а) Fe(OH)2 + 2H+ = Fe2+ + H2O;
б) Ca2+ + CO32- = CaCO3¯
177 Напишите по два молекулярных уравнения к каждому из ионно-молекулярных уравнений:
а) H+ + CH3COO- = CH3COOH.
б) Pb2+ + 2I- = PbI2¯
178 Составьте молекулярные уравнения реакций к каждому из ионно-молекулярных уравнений:
а) 2Al(OH)3 + 6H+ = 3H2O + 2Al3+
б) Ba2+ + CrO42- = BaCrO4.
179 Составьте два молекулярных уравнения реакций к каждому из ионно-молекулярных реакций:
а) Cr2+ + SO42- = CrSO4
б) ZnS + 2H+ = H2S + Zn2+
180 Напишите в молекулярной и ионно-молекулярной формах реакции взаимодействия между:
а) гидроксидом цинка и серной кислотой;
б) гидроксидом цинка и гидроксидом натрия.
5.5 Гидролиз солей
Гидролиз солей. В водных растворах может происходить взаимодействие ионов соли с молекулами воды.
Процесс обменного взаимодействия ионов соли с водой, который приводит к образованию малодиссоциированных соединений (слабых кислот и оснований, или гидро- и гидроксоионов) и изменению характера среды раствора (рН), называется гидролизом соли. Например,
NaCN + H2O «HCN + NaOH, pH>7
NH4Cl + H2O «NH4OH + HCl, pH<7.
Так как обязательным условием гидролиза соли является образование хотя бы одного слабого электролита (кислоты или основания), то гидролизу подвергаются соли, образованные слабой кислотой и сильным основанием (Na2CO3, КСN) или сильной кислотой и слабым основанием (NH4Cl, ZnSO4). Соли, образованные слабой кислотой и слабым основанием (Al2S3, CuSO3), гидролизуются в значительной степени. Соли сильного основания и сильной кислоты (NaCl, K2SO4) гидролизу не подвергаются.
Например, уравнения реакции гидролиза соли CH3COOK будут иметь следующий вид:
в молекулярной форме:
СН3СООК + Н2О «СН3СООН + КОН;
в ионно-молекулярной форме:
СН3СОО- + К+ + НОН «СН3СООН + К+ + ОН-;
в сокращенной ионно-молекулярной форме:
СН3СОО- + НОН «СН3СООН + ОН-.
Характер среды – щелочной.
Количественной мерой гидролиза являются степень и константа гидролиза. Степень гидролиза (h) – величина, которая показывает какая часть растворенной соли [С(В)] подверглась гидролизу и измеряется в долях единицы или в %:
h =C(B)г / С(В), откуда С(В)г = С(В)×h
Степень гидролиза соли зависит от следующих факторов:
- природы соли, чем слабее кислота или основание, образующие соль, тем больше степень гидролиза.
- температуры, с повышением температуры гидролиз усиливается.
- концентрации раствора соли, при разбавлении раствора (уменьшении концентрации) степень гидролиза возрастает.
- добавления сильных кислот или оснований в раствор соли: так можно усилить или ослабить гидролиз.
Задачи к разделу 5.5:
«Гидролиз солей»
181 Составьте ионно-молекулярные и молекулярные уравнения ступенчатого гидролиза солей: сульфида калия и сульфата меди. Определите рН растворов этих солей.
182 Напишите уравнения ступенчатого гидролиза солей в ионно-молекулярной и молекулярной формах: K2SO3 и CrCl3. Определите молекулярные массы продуктов гидролиза первой ступени той и другой соли.
183 Определите характер среды в растворах следующих солей К2СО3, Na2SO4 и NH4Cl. Ответ подтвердите соответствующими ионно-молекулярными и молекулярными уравнениями реакций.
184 Составьте уравнения ступенчатого гидролиза солей в ионно-молекулярной и молекулярной формах:
а) карбоната натрия; б) сульфата железа (III).
185 Подберите по два уравнения в молекулярном виде к каждому из ионно-молекулярных уравнений:
а) CrOH2+ + HOH «Cr(OH)2+ + H+;
б) CO32- + HOH «HCO3- + OH-.
186 Укажите, добавление каких реагентов из перечисленных ниже к раствору хлорида алюминия усилит гидролиз этой соли: а) NaOH; б) HCl; в) NH4Cl. Дайте объяснения и подтвердите уравнениями реакций в ионно-молекулярной и молекулярной формах.
187 При смешении водных растворов хлорида хрома и сульфида натрия выделяется газ и образуется осадок. Напишите соответствующие уравнения в ионно-молекулярной и молекулярной формах
188 Дайте объяснение, почему раствор гидрокарбоната натрия имеет слабощелочную, и раствор гидросульфита натрия – слабокислую. Подтвердите уравнениями реакций.
189 Укажите, какие из перечисленных ниже солей подвергаются гидролизу: а) нитрит натрия; б) перхлорат калия; в) ацетат аммония. Для гидролизующихся солей напишите уравнения реакций в ионно-молекулярном и молекулярном виде.
190 Укажите, в водном растворе какой соли водородный показатель рН будет больше: а) хлорида меди; б) сульфида калия; в) сульфата натрия. Дайте объяснение и подтвердите соответствующими уравнениями в ионно-молекулярном и молекулярном виде.
191 При смешении водных растворов нитрата алюминия и карбоната калия образуется осадок и выделяется газ. Составьте соответствующие уравнения реакций в молекулярной и ионно-молекулярной формах.
192 Напишите уравнения ступенчатого гидролиза солей в молекулярном и ионно-молекулярном виде: а) сульфата меди; б) сульфида калия. Определите молекулярную массу продуктов гидролиза солей по первой ступени.
193 Напишите уравнения ступенчатого гидролиза в молекулярном и ионно-молеклярном виде: а) сульфата алюминия; б) нитрата меди.
194 Напишите уравнения ступенчатого гидролиза солей в ионно-молекулярной и молекулярной формах: сульфата хрома и сульфита калия. Определите характер среды в растворах и назовите все продукты гидролиза.
195 При смешивании водных растворов нитрата железа (III) и сульфида калия образуется осадок гидроксида железа (III). Напишите соответствующие уравнения реакций.
196 Сульфиды трехвалентных металлов подвергаются полному и необратимому гидролизу. Составьте ионно-молекулярные и молекулярное уравнение гидролиза сульфида железа.
197 Составьте уравнения гидролиза солей в молекулярной и ионно-молекулярной формах: хлорида цинка и карбоната калия. Назовите полученные продукты гидролиза и укажите, добавлением каких реагентов можно уменьшить гидролиз этих солей.
198 При смешивании водных растворов хлорида хрома (III) и карбоната натрия образуется осадок гидроксида хрома (III). Дайте объяснения и напишите уравнения реакций в молекулярной и ионно-молекулярной формах.
199 Составьте ионно-молекулярные и молекулярное уравнения гидролиза сульфида хрома (III). К какому типу гидролиза относится этот процесс?
200 Напишите уравнения реакций ступенчатого гидролиза сульфата хрома (III) в молекулярной и ионно-молекулярной формах и назовите все, образующиеся в результате гидролиза соединения. Определите pH раствора этой соли.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
1 Коровин Н.В. Общая химия.-М.: Высш. шк., 2003.- 558 с.
2 Глинка Н.Л. Общая химия. – М.: Интеграл – Пресс, 2002. – 729 с.
3 Глинка Н.Л. Задачи и упражнения по общей химии. – М.: Интеграл – Пресс, 2008. – 240 с.
4 Васильева З.Г. Лабораторные работы по общей и неорганической химии. – М.: Химия, 1988. – 336 с.
5 Лидин Р.А., Андреева Л.Л., Молочко В.А. Справочник по неорганической химии. – М.: Химия, 1987. – 320 с.
ТАБЛИЦА ВАРИАНТОВ КОНТРОЛЬНЫХ ЗАДАНИЙ
Дата добавления: 2015-10-24; просмотров: 199 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Химическое равновесие | | | Западная философия |