
|
Читайте также: |
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Государственное общеобразовательное учреждение высшего профессионального образования
Московский государственный университет дизайна и технологии
Новосибирский технологический институт
Московского государственного университета дизайна и технологии (филиал)
(НТИ МГУДТ (филиал))
Кафедра химии
КОНТРОЛЬНАЯ РАБОТА № 1
по дисциплине «Химия»
по направлению 260800.62 – “Технология и конструирование изделий и
материалы легкой промышленности”
по направлению 260900.65 – “Технология и конструирование изделий легкой промышленности”
по специальности:
260901.65 – Технология швейных изделий
260905.65 – Технология изделий из кожи
260902.65 – Конструирование швейных изделий
Новосибирск-2010
Методическая разработка составлена на основании следующих нормативных документов:
Государственный образовательный стандарт высшего профессионального образования. Направление подготовки дипломированного специалиста 260900.65 -“Технология и конструирование изделий легкой промышленности”. Квалификация выпускника – инженер. – М.: Министерство образования РФ. 2000. Номер государственной регистрации 194 тех./ДС. Утвержден 23.03.2000.
Разработчик: В.Н. Бондарев
доцент, к.т.н.
Рецензент: В.А. Логвиненко
профессор, д.х.н.
Методическая разработка рассмотрена на заседании кафедры химии,
протокол № ______ от «____» ___________ 2010 г.
Зав. кафедрой А.Ф. Федяшина
Декан ФЗОиЭ А.Р. Соколовский
СОДЕРЖАНИЕ
| Стр. | |
| 1. Методические указания ______________________________________ | |
| 2. Раздел 1. Основные понятия и законы химии ____________________ | |
| 2.1 Основные понятия химии__________________________________ | |
| 2.2 Основные законы химии ________________________________ | |
| 3. Раздел 2. Строение атома. Химическая связь ___________________ | |
| 2.1 Строение атома _________________________________________ | |
| 2.2 Химическая связь _______________________________________ | |
| 4. Раздел 3. Энергетика химических процессов. Термохимия ________ | |
| 3.1 Термохимия ___________________________________________ 3.2 Энтропия химических реакций ___________________________ 3.3 Энергия Гиббса ________________________________________ | |
| 5. Раздел 4. Кинетика химических реакций. Химическое равновесие __ | |
| 4.1 Скорость химических реакций ___________________________ 4.1.1 Скорость химических реакций в гомогенной системе ________ 4.1.2 Скорость химических реакций в гетерогенной системе ______ 4.2 Факторы, влияющие на скорость реакции ___________________ 4.2.1 Концентрация реагирующих веществ _____________________ 4.2.2 Давление _____________________________________________ 4.2.3 Температура ___________________________________________ 4.3 Химическое равновесие __________________________________ 4.3.1 Принцип Ле-Шателье __________________________________ | |
| 6. Раздел 5. Растворы. Концентрация растворов. Гидролиз солей _____ | |
| 5.1 Концентрация растворов _________________________________ 5.2 Свойства растворов неэлектролитов ________________________ 5.2.1 Осмотическое давление _________________________________ 5.2.2 Давление пара растворителя над разбавленными растворами неэлектролитов _________________________________________ 5.2.3 Температура кипения и кристаллизации разбавленных растворов неэлектролитов ______________________________________ 5.3 Свойства растворов электролитов _______________________ 5.3.1 Степень диссоциации __________________________________ 5.3.2 Константа диссоциации ________________________________ 5.3.3 Ионное произведение воды. Водородный показатель ________ 5.4 Реакции ионного обмена ________________________________ 5.5 Гидролиз солей _________________________________________ | |
| 7. Рекомендуемая литература ___________________________________ 8. Таблица вариантов __________________________________________ |
Методические указания
Работа студента над разделами курса «Химия» должна начинаться с самостоятельного изучения материала по учебникам и учебным пособиям. Для лучшего усвоения материала необходимо конспектировать основные формулировки законов, незнакомые термины, химические формулы и уравнения реакций, математические зависимости и т.п.
Контрольная работа выполняется в ученической тетради. После указания номера задания пишется содержание вопроса или условие задачи так, как они даются в данном пособии. Задания выполняются в том порядке, в каком они следуют в Вашем варианте. При решении задач необходимо производить все математические действия, используя при этом стандартные обозначения мер и других величин. Ответы на теоретические вопросы должны быть краткими, но обоснованными.
Аккуратно оформленная работа, подписанная студентом с указанием даты выполнения и шифра (номера студенческого билета), представляется на рецензирование в институт. Незачтенная работа возвращается студенту на доработку. Исправление необходимо выполнять в той же тетради в соответствии с указаниями рецензента, но не в рецензированном тексте. Работа после исправления замечаний возвращается на повторное рецензирование.
Контрольная работа, выполненная не по своему варианту, преподавателем не рецензируется и не засчитывается.
Вариант контрольной работы, выполняемой студентом, определяется двумя последними цифрами номера его студенческого билета (шифра). Например, номер студенческого билета 2046, последние две цифры – 46, из чего следует, что студент должен выполнять задания, включенные в вариант 46.
Раздел 1
Основные понятия и законы химии
Химия изучает превращение одних веществ в другие. При химических процессах происходит обмен атомами между различными веществами, перераспределение электронов между атомами элементов, разрушение одних соединений и возникновение других. Например:
NaOH + HCl = NaCl +H2O.
1.1 Основные понятия химии
Объектом изучения химии являются химические элементы и их соединения. Например: N, Cl2, NH3, HCl.
Химический элемент – вид атомов с одинаковым зарядом ядра: Al, K, S.
Атом – наименьшая электронейтральная частица химического элемента, сохраняющая все его химические свойства. Состоит из положительно заряженного ядра и отрицательно заряженных электронов. Например,  : порядковый номер элемента в периодической системе – 30, относительная атомная масса – 65, число электронов в электронной оболочке (–30) равно числу протонов, определяющих заряд ядра атома (+30). Ядро атома: число протонов (+30) и число нейтронов (65 – 30 = 35)
: порядковый номер элемента в периодической системе – 30, относительная атомная масса – 65, число электронов в электронной оболочке (–30) равно числу протонов, определяющих заряд ядра атома (+30). Ядро атома: число протонов (+30) и число нейтронов (65 – 30 = 35)
Молекула – это наименьшая частица вещества, обладающая его химическими свойствами. Химические свойства молекулы определяются ее составом и химическим строением. Например: H2O, H2SO4, KOH.
Вещества, молекулы которых содержат атомы только одного элемента, называют простыми. Например: K, H2, O2, O3, Ar, N2.
Вещества, молекулы которых состоят из атомов разных элементов, называют сложными веществами или химическими соединениями. Например: CO, H2O, HCl, H2SO4, Na2 SO4, CH4, C2H5OH.
Химическое уравнение – это запись химической реакции с помощью формул реагентов и продуктов с указанием их количеств в молях. Например:
CaCO3 + 2HCl = CaCl2 + CO2 +H2O.
В химическом уравнении число атомов каждого элемента в левой и правой частях уравнения одинаково. Числа, стоящие перед химическими формулами, называются стехиометрическими коэффициентами.
Абсолютные массы атомов ничтожно малы. Так, например, масса атома водорода составляет 1,674 · 10-27 кг, кислорода – 26,67 · 10-27 кг, углерода -
19,93·10-27 кг. Поэтому в химии используются не абсолютные значения атомных масс, а относительные. За единицу атомной массы принята 1/12 часть массы изотопа углерода 12С.
Относительная атомная масса элемента (Ar) – это величина, равная отношению абсолютной массы атома к 1/12 части абсолютной массы изотопа углерода 12С. Например:
Ar(H) = m(H) / 1/12 m 12C = 1,674 · 10-27/ 1/12 × 19,93·10-27кг = 1,0079.
Ar(O) = 
Относительная молекулярная масса (Mr) – это величина, равная отношению абсолютной средней массы молекулы естественного изотопического состава вещества к 1/12 массы атома углерода 12С. Она численно равна сумме относительных атомных масс всех атомов, входящих в состав молекулы вещества. Например: Mr(H2O):
2Ar(H) = 2 · 1,00797 = 2,01594
Ar(O) = 1 · 15,9994 = 15,9994
 Mr(H2O) = 18,01534 или Mr(H2O) = 18.
Mr(H2O) = 18,01534 или Mr(H2O) = 18.
Полученное число показывает, во сколько раз масса молекулы H2O больше 1/12 массы 12С.
Количество вещества определяется числом структурных единиц (атомов, молекул, ионов и др.) этого вещества. Единицей количества вещества является моль.
Моль – это количество вещества, содержащее столько структурных единиц (молекул, атомов, ионов и др.), сколько атомов содержится в 0,012 кг изотопа углерода 12С.
Зная массу одного атома углерода (19,93 ·10-27 кг), можно вычислить число атомов NА в 0,012 кг углерода:
NА = 
Это число называется постоянной Авогадро, показывает число структурных единиц в моле любого вещества.
Молярная масса вещества (М) – это масса одного моля, равная отношению массы к количеству вещества.
М =  ,
,
где m – масса вещества, г;
 - количество вещества, моль.
- количество вещества, моль.
Молярная масса имеет размерность г/моль или кг/моль.
Молярную массу вещества легко вычислить, зная массу молекулы.
Например, масса молекулы воды равна 2,99·10-26 кг, то молярная масса М(H2O) = 2,99·10-26 кг · 6,02·1023 г/моль = 0,018 кг/моль.
Численное значение молярной массы равно относительной молекулярной или атомной массе.
Например: M(H2O) = 18 г/моль; Mr(H2O) =18
M(H2SO4) = 98 г/моль; Mr(H2SO4) = 98.
Отсюда, зная молярную массу вещества, легко определить массу атома или молекулы этого вещества, разделив молярную массу на число Авогадро (NA). Например: m(O) = 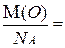

m(H2O) = 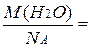


Пример 1. Определите количество вещества брома Br2, содержащегося в молекулярном броме массой 12,8 г.
Решение.
Молярная масса Br2 составляет:
М(Br2) = 2М(Br) = 2·80 = 160 г/моль
Определяем количество вещества Br2
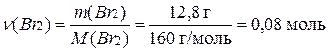
Пример 2. Сколько молекул содержится в молекулярном йоде массой 50,8 г?
Решение.
Молярная масса йода составляет
М(J2) = 2М(J) = 2·127 = 254 г/моль
Определяем количество вещества J2
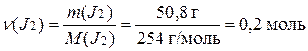
Используя число Авогадро (NA), находим число (n) молекул J2.
N(J2) = n(J2)×NA = 0,2×6,02×1023 = 1,2×1023 молекул.
Эквивалент – это реальная или условная частица вещества, которая соответствует одному иону (атому) водорода в ионно–обменных реакциях, или одному электрону в окислительно–восстановительных реакциях.
Молярная масса эквивалента – это масса одного моля эквивалента.
Обозначается М(1/z B) – г/моль.,
где 1/z - фактор эквивалентности;
z - число эквивалентности;
В – вещество.
n(1/z B) – количество эквивалентов вещества, (моль).
М(1/z В) – молярная масса эквивалента вещества В, (г/моль).
Например:
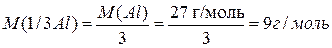 ;
;
 .
.
1.2 Основные законы химии
Закон сохранения массы вещества. Масса веществ, вступающих в реакцию, равна массе веществ, образующихся в результате реакции.
Например, Н2 + Сl2 = 2HCl
Так как атомы имеют постоянную массу, то не меняется масса веществ до и после реакции.
Закон постоянства состава
Каждое химически чистое вещество имеет один и тот же качественный и количественный состав независимо от способа его получения.
Например: 2H2 + O2 = 2H2O
NaOH + HCl = NaCl + H2O
CH4 + 2O2 = CO2 + 2H2O
Во всех реакциях состав H2O: (ω(H)=1,11%; ω(О)=88,89%).
Закон эквивалентов
Вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам, т.е. моль эквивалентов одного вещества реагирует с одним молем эквивалентов другого вещества.
Например, в реакции 1/3Al + HCl = 1/3AlCl3 + 1/2H2 один моль эквивалентов алюминия (1/3 моль Al)реагирует с одним молем эквивалентов кислоты (1 моль HCl) с образованием одного моля эквивалентов хлорида алюминия (1/3 моль AlCl3) и одного моля эквивалентов водорода (1/2 моль Н2).
Математическое выражение закона эквивалентов:
 ,
,
где m(A) и m(B) – массы взаимодействующих веществ А и В, г;
М(1/z А) и М(1/z В) – молярные массы эквивалентов этих веществ, г/моль.
Если одно из веществ является газом, то закон эквивалентов принимает вид:
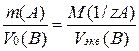 ,
,
где Vo(В) – объем газа (при н.у.), л;
Vэкв(В) – объем моля эквивалентов газа, л.
Определяется как  , где Vo – молярный объем газа, л.
, где Vo – молярный объем газа, л.
Пример 3.Определите молярную массу эквивалента металла, если при взаимодействии металла массой 7,20г с хлором была получена соль массой 28,20г. Молярная масса эквивалента хлора – 35,45 г/моль.
Решение. Находим массу хлора.
m(Cl) = m(соли) – m(Me) = 28,20 – 7,20 = 21,00 г
По закону эквивалентов определяем молярную массу эквивалента металла.
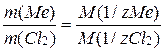

Пример 4. На восстановление оксида металла массой 1,8 г израсходован водород объемом (н.у.) 833 см3. Вычислите молярные массы эквивалентов оксида и металла.
Решение. По закону эквивалентов определяем молярную массу эквивалента оксида, зная что Vэкв(Н2) = 11,2 л /моль
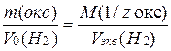

M(1/zMe) = M(1/z окс) – M(1/z O) =24,2 – 8,0 = 16,2 г/моль.
Состояние газа характеризуется его температурой, давлением и объемом. Если температура газа равна 273 К (0оС), а давление 101,3 кПа (760 мм.рт.ст.), то условия, при которых находится газ, называются нормальными. Объем, занимаемый газом при этих условиях, принято обозначать через Vo, а давление через Ро.
При нормальных условиях 1 моль различных газов занимает объем, равный 22,4 л ·моль-1.
Этот объем называют мольным объемом газа (Vm). Мольный объем газа (Vm) – это отношение объема газа к его количеству:
 ,
,
где Vm – мольный объем газа (л/моль);
Vo –объем газа (л);
n - количество газа (моль).
В равных объемах газов при одинаковых условиях содержится одинаковое число молекул, а следовательно, и молей газов. Отношение масс данных объемов газов равно отношению их молярных масс:
m1: m2 = M1: M2,
где m1 и m2 – массы газов, г;
M1 и M2 – их молярные массы, г/моль.
Отношение массы определенного объема одного газа к массе такого же объема другого газа (взятых при одинаковых условиях) называют плотностью первого газа по второму (обозначается буквой Д).
 Отсюда Д =
Отсюда Д =  и M1 = ДМ2
и M1 = ДМ2
Обычно плотность газа определяют по водороду (обозначается  ), молярная масса которого 2 г/моль, или по воздуху (обозначают Д(В)), средняя молярная масса которого равна 29 г/моль. Отсюда, молярная масса вещества в газообразном состоянии равна: М = 2
), молярная масса которого 2 г/моль, или по воздуху (обозначают Д(В)), средняя молярная масса которого равна 29 г/моль. Отсюда, молярная масса вещества в газообразном состоянии равна: М = 2  или М = 29Д(В).
или М = 29Д(В).
Пример 5. Относительная плотность галогеноводорода по воздуху равна 2,8. Определите плотность этого газа по водороду и назовите его.
Решение. Определяем молярную массу галогеноводорода(НГ).
М(НГ) = 29Д(В) = 29 × 2,8 = 81 г/моль.
Далее находим молярную массу галогена.
М(Г) = М(НГ) – М(Н) = 81 – 1 = 80 г/моль.
Следовательно, галоген-бром, а газ-бромоводород.
Вычисляем плотность HBr по водороду:

Зависимость между объемом газа, давлением и температурой выражается уравнением Клапейрона:
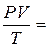
 ,
,
где P,V – давление и объем при данной температуре, Т;
Pо, Vо, То – давление, объем и температура при нормальных условиях.
Пример 6. При температуре 25оС и давлении 99,3 кПа некоторое количество газа занимает объем 152 см3. Определите, какой объем будет занимать этот газ при нормальных условиях.
Решение. Используя уравнение Клапейрона получаем:
Vо = 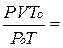
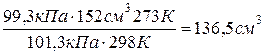 .
.
Пример 7. Какой объем (л) займет при температуре 20оС и давлении 250 кПа аммиак массой 51 г?
Решение. Определяем количество вещества аммиака:
n(NH3) = 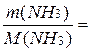

Объем газа при нормальных условиях составит:
V0(NH3) = Vm × ν(NH3) = 22,4 × 3 = 67,2 (л).
Далее по уравнению Клапейрона определяем объем аммиака при данных условиях задачи:
V(NH3) = 
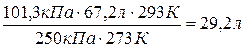 .
.
Для любого газа количеством 1 моль величина  постоянна, одинакова и ее называют универсальной газовой постоянной R. Она имеет различные значения. Так, если давление измерено в Па, а объем в м3, то R = 8,31Дж×моль-1×К-1 (1Дж=Па×м3). Если давление в мм.рт.ст., а объем в (л), то R = 62,36 мм.рт.ст.×л×моль-1×К-1. Уравнение Клапейрона принимает вид PV=RT (для ν=1 моль).
постоянна, одинакова и ее называют универсальной газовой постоянной R. Она имеет различные значения. Так, если давление измерено в Па, а объем в м3, то R = 8,31Дж×моль-1×К-1 (1Дж=Па×м3). Если давление в мм.рт.ст., а объем в (л), то R = 62,36 мм.рт.ст.×л×моль-1×К-1. Уравнение Клапейрона принимает вид PV=RT (для ν=1 моль).
Для n-молей газа:
PV=nRT или PV=  .
.
Данное уравнение получило название уравнения Менделеева-Клапейрона (уравнение состояния идеального газа.) Оно связывает массу газа (кг), температуру (К), давление (Па) и объем (м3) с его молярной массой (кг/моль). При этом R=8,31 Дж/моль×К.
Пример 8. Вычислите молярную массу бензола, если масса 600 см3 его паров при температуре 870С и давлении 83,2 кПа равна 1,3 ×10-3 кг.
Решение. Используя уравнение Менделеева-Клапейрона, находим:
М= 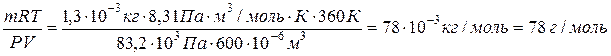 .
.
Пример 9. Газометр объемом 20 л наполнен газом. Плотность этого газа по воздуху 0,4, давление 103,3 кПа, температура 170С. Определите массу газа.
Решение. Находим молярную массу газа.
М(газа) = 29 × Д(В) = 29×0,4 = 11,6 г/моль
Далее по уравнению Менделеева-Клапейрона определяем массу газа.
m(газа) = 
Газы часто представляют собой смеси индивидуальных газообразных веществ. Так, воздух является смесью азота, кислорода, аргона и др.
Парциальным давлением газа в газовой смеси называется давление, которое производил бы газ, занимая при тех же условиях объем газовой смеси.
Закон парциальных давлений ( Дальтон).
Общее давление смеси газов, не вступающих друг с другом в химическое взаимодействие, равно сумме парциальных давлений газов, составляющих смесь.
Р = р1 + р2 +…+рn, где
Р – общее давление газовой смеси
р1,р2,рn – парциальное давление газов.
Парциальное давление газа в газовой смеси можно рассчитать по уравнению Менделеева-Клапейрона.
Пример 10. Газовая смесь приготовлена из 2 л водорода (Рнач. =93,3 кПа) и 5 л метана (Рннач. = 112 кПа). Объем смеси равен 7 л. Рассчитайте парциальные давления газов и общее давление смеси.
Решение. Зная объемы газов и смеси, находим парциальные давления газов:

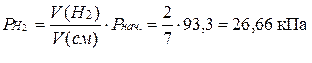
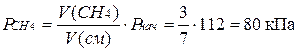
Общее давление газовой смеси равно сумме парциальных давлений газов.
Р = Р(H2) + P(CH4) = 26,66 + 80 = 106,66 кПа.
Пример 11. При температуре 0оС в сосуде объемом 14,0×10-3 м3 содержится водород массой 0,8 ×10-3 кг и азот массой 6,3×10-3 кг. Определите парциальное давление газов и общее давление газовой смеси.
Решение. По уравнению Менделеева-Клапейрона находим парциальное давление газов.
Р(H2) = 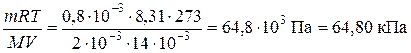
Р(N2) = 
Робщ. = Р(Н2) + P(N2) = 64,80 + 36,46 = 101,26 кПа
Если газ собран над жидкостью, то при расчетах следует иметь в виду, что его давление является парциальным и равно разности общего давления газовой смеси и парциального давления пара жидкости. Например, газ собран над водой при температуре 20оС и давлении 100 кПа, а давление насыщенного пара воды при 20оС равно 2,3 кПа. Тогда, парциальное давление газа будет равно 100 – 2,3 = 97,7 кПа. Этой величиной пользуются в дальнейших расчетах.
Пример 12. Водород объемом 250 см3 собран над водой при температуре 26оС и давлении 98,7 кПа. Давление насыщенного пара воды при 26оС составляет 3,4 кПа. Вычислите объем водорода при нормальных условиях и его массу.
Решение. Находим парциальное давление водорода.
Р(Н2) = Р - Р(Н2О) = 98,7 – 3,4 = 95,3 кПа.
По уравнению Клапейрона определяем объем водорода (н.у.)
V0(H2) = 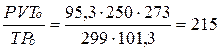 см3
см3
Находим количество водорода этого объема.
n(Н2) = 
Отсюда масса водорода:
m(H2) = nM = 0,0096×2=0,019 г.
Пример 13. Определите молекулярную формулу соединения, содержащего 30,43% азота и 69,57% кислорода (по массе). Плотность этого вещества по водороду равна 46.
Решение. Находим молярную массу этого вещества.
M(NxOy) = 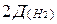 = 2×46 =92 г/моль.
= 2×46 =92 г/моль.
Определяем массу азота и кислорода в моле этого соединения.
m(N) = 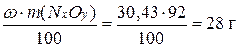
m(O) = 
Отсюда 14 х: 16 у = 28: 64
х: y =  x = 2; y = 4
x = 2; y = 4
Формула – N2O4.
Задачи к разделу 1:
«Основные понятия и законы химии»
1 На осаждение хлора, содержащегося в 0,666×10-3 кг соли, израсходовано 1,088×10-3 кг AgNO3. Вычислите молярную массу эквивалента соли.
2 В закрытом сосуде объемом 5 л находится при температуре 15оС смесь, состоящая из 4,4г СО2, 6,4 г О2 и 2,4г СН4. Вычислите общее давление газовой смеси, парциальные давления газов и процентный состав смеси по объему.
3 Металл массой 0,70 г вытеснил из кислоты 418 см3 водорода, собранного над водой при температуре 150С и давлении 94,3 кПа. Давление водяного пара при этой температуре равно 1,7 кПа. Определите молярную массу эквивалента металла.
4 Вычислите среднюю плотность по воздуху газовой смеси, имеющей объемный состав: 52% СН4 и 48% С2Н4.
5 При нагревании 0,612г некоторого вещества выделилось 0,168л кислорода (н.у.) и образовалось 0,372г хлорида калия. Определите формулу этого вещества.
6 В газометре над водой при температуре 200С и давлении 98500 Па находится 8×10-3 м3 кислорода. Давление водяного пара при 200С равно 2335 Па. Какой объем (н.у.) займет кислород, находящийся в газометре.
7 Масса газа объемом 0,327 л при температуре 130С и давлении 1,040×105 Па равна 0,838 г. Вычислите молекулярную массу газа.
8 Объем резиновой камеры автомобильной шины равен 0,025 м3, давление в ней 5,066×105 Па. Определите массу воздуха в камере при температуре 200С.
9 Вычислите, какое давление надо приложить, чтобы хлор массой 28,4г занимал объем 2,0 л при температуре 200С?
10 В сосуде объемом 0,050 м3 при температуре 250С содержится смесь из 0,020 м3 этилена под давлением 83950 Па и 0,015 м3 метана под давлением 95940 Па. Найдите парциальные давления газов и общее давление газов в сосуде.
11 Газовая смесь состоит из 5 л азота, находящегося под давлением 95940 Па и 3 л кислорода. Объем смеси 8 л. Общее давление газовой смеси 104200 Па. Под каким давлением был взят кислород?
12 В закрытом сосуде объем 0,6 м3 при температуре 00С находится смесь, состоящая из 0,20 кг СО2, 0,40 кг О2 и 0,15 кг СН4. Вычислите: а) парциальные давления газов; б) общее давление газовой смеси.
13 В газонаполненных лампах содержится смесь газов, имеющая объемный состав: 86% Ar и 14% N2. Рассчитайте парциальные давления газов, если общее давление равно 39990 Па.
14 Сухой воздух имеет примерно следующий объемный состав: 78,09 % N2, 20,95 % О2, 0,93% Ar и 0,03% СО2. Вычислите парциальные давления этих газов, если общее давление газовой смеси 101325 Па.
15 В закрытом сосуде объемом 6 л находится при температуре 100С смесь, состоящая из 8,8 г СО2, 3,2 г О2 и 1,2 г СН4. Вычислите общее давление газовой смеси, парциальные давления газов и процентный состав смеси по объему.
16 Металл массой 0,35 г вытеснил из кислоты 209 см3 водорода, собранного над водой при температуре 200С и давлении 104,3 кПа. Давление водяного пара при этой температуре равно 2,3 кПа. Определите молярную массу эквивалента металла.
17 При нагревании 1,225г некоторого вещества выделилось 0,336л кислорода (н.у.) и образовалось 0,745г хлорида калия. Определите формулу этого вещества.
18 Определите молекулярную формулу оксида хлора, если при разложении оксида объемом 0,10л получились кислород и хлор объемом 0,10л и 0,05л соответственно (н.у.) Относительная плотность этого оксида по воздуху равна 2,34.
19 Определите формулу вещества, состоящего из углерода, водорода и кислорода, зная, что при сжигании 0,145г его получено 0,330г СО2 и 0,135г Н2О. Относительная плотность пара этого вещества по водороду равна 29.
20 Какова простейшая и молекулярная формулы газообразного углеводорода, если в нем содержится 81,82% углерода и 18,18% водорода, а 1л этого углеводорода (н.у.) имеют массу 2,6 г?
Раздел 2
Строение атома. Химическая связь
2.1 Строение атома
Порядковый номер химического элемента в периодической системе Д.И.Менделеева соответствует числу протонов в ядре атома элемента и числу электронов в электронной оболочке атома. Химические свойства соединений зависят в основном от строения внешних электронных уровней атомов элементов.
Описать строение электронных оболочек атомов можно с помощью принципа Паули, наименьших энергий и правила Гунда, используя для этого представления о квантовых числах.
Главное квантовое число ”n” в многоэлектронном атоме обозначает номер электронного уровня. Оно принимает целочисленные значения от 1 до ∞: n = 1, 2, 3, … и характеризует энергию электрона, размер электронного облака, число энергетических подуровней внутри каждого уровня.
Орбитальное квантовое число ”ℓ” характеризует электронные подуровни. Оно принимает для данного ”n” все целочисленные значения от 0 до (n - 1): ℓ = 0, 1, 2…(n - 1). Подуровни, характеризующиеся значениями ℓ, равными 0, 1, 2, 3, называют соответственно s-, p-, d-, f-подуровнями, а находящиеся на них электроны - s-, p-, d-, f - электронами. Все орбитали одного подуровня имеют одинаковую форму электронных облаков.
Магнитное квантовое число ”mℓ” принимает все целочисленные значения от –ℓ до + ℓ, включая ”0”: mℓ = -3, -2, -1, 0, +1, +2, +3. Число значений ”mℓ” соответствует числу орбиталей в подуровне и их ориентации в пространстве.
Пример 1. Сколько орбиталей включает р-подуровень?
Решение. Для р-подуровня ℓ = 1. Число значений mℓ равно трем (+1, 0, -1), следовательно р-подуровень включает три р-орбитали (px, py, pz) с их ориентацией по координатам x, y, z.
Спиновое квантовое число ”ms” принимает два значения +1/2 и –1/2 и характеризует магнитное поле электрона. Если атом имеет два электрона, и оба они характеризуются ms = +1/2, то суммарный спин равен 1; если один электрон атома характеризуется ms = +1/2, а другой - ms = -1/2, то суммарный спин равен нулю (правило Гунда). Электрон с соответствующим квантовым числом обозначается в электронно-графических формулах стрелочкой, например, ↓, что соответствует ms = -1/2 или ↑ - ms = +1/2.
Система четырех квантовых чисел позволяет установить, как распределяются по уровням, подуровням и орбиталям электроны атома. Однако в атоме не может быть двух электронов, характеризующихся одинаковыми наборами четырех квантовых чисел (принцип Паули). Он определяет общее число электронов в атоме.
Пример 2. Сколько электронов может содержать первый энергетический уровень?
Решение. Для первого уровня n = 1. Следовательно, ℓ = 0; mℓ = 0; ms может быть +1/2 и –1/2. Кратко комбинации квантовых чисел можно выразить такой последовательностью: n, ℓ, mℓ, ms. Для первого уровня можно составить следующие комбинации квантовых чисел 1, 0, 0, +1/2 и 1, 0, 0, -1/2. Отсюда следует, что первый уровень может содержать два электрона, а первый период таблицы Д.И.Менделеева должен содержать два элемента.
Максимальное число электронов на энергетическом уровне определяют по формуле z = 2n2, где n – номер энергетического уровня, совпадающий со значением главного квантового числа (n = 1, 2, 3 и тд.).
Максимальное число электронов на энергетическом подуровне определяют по формуле z=2ּ(2ℓ+1), где ℓ – номер энергетического подуровня, совпадающий со значением орбитального квантового числа (ℓ = 0, z = 2; ℓ = 1, z = 6; ℓ = 2, z = 10; ℓ = 3, z = 14).
Заполнение электронами атомных орбиталей (АО) в многоэлектронных атомах основано на принципе наименьшей энергии. Каждый электрон занимает ту из доступных для него орбиталей, на которой его энергия будет наименьшей.
Последовательность заполнения электронами подуровней многоэлектронных атомов основана на этом же принципе и согласно правила Клечковского зависит от суммы (n+ℓ).


 В пределах каждого значения суммы (n+ℓ) порядок заполнения подуровней соответствует возрастанию главного квантового числа.
В пределах каждого значения суммы (n+ℓ) порядок заполнения подуровней соответствует возрастанию главного квантового числа.
Например,
Подуровни
а) 3s 3p; б) 3d 4s; в) 3d 4p
n 3 3 3 4 3 4
ℓ 0 1 2 0 2 1
n+ℓ 3 4 5 4 5 5
3s < 3p 4s < 3d 3d ≈ 4p
Е3s < Е3р Е4s< Е3d Е3d ≈ E4p
В случае в) при одинаковой сумме квантовых чисел предпочтение в распределении электронов по орбиталям следует отдать орбитали 3d, как имеющей меньшее значение n = 3.
Пример 3. Какова последовательность заполнения электронами таких подуровней, для которых сумма (n + ℓ) равна 5?
Решение. Составим таблицу возможных значений n и ℓ.
n + ℓ 5
n 3 4 5
ℓ 2 1 0
подуровни 3 d 4 p 5 s
Пример 4. Напишите электронную формулу атома элемента с порядковым номером 12. Определите число электронов на внешнем уровне, к какому семейству элементов данный атом принадлежит, в каком периоде, группе он находится.
Решение. В соответствии с правилом Клечковского подуровни заполняются в такой последовательности: 1s 2s 2p 3s 3p. Из принципа Паули следует, что максимальное число электронов на s – подуровне равно 2, на p – подуровне 6. Суммарное число электронов составило 12: 1 s2 2 s2 2 p6 3 s2. Это элемент второй группы, так как на внешнем уровне два электрона на s-подуровне и поэтому он относится к семейству s-элементов. Элемент находится в третьем периоде, так как максимальное значение главного квантового числа равно трем.
Строение атома выражают электронной и электронно-графической формулами. Например, строение атома фтора с порядковым номером девять выражают электронной формулой: 1s2 2s2 2p5 и электронно-графической формулой:
9F
| ↑↓ | ↑↓ | ↑ | ||
| ↑↓ | ||||
| ↑↓ |
Или 1 s 2 s 2 p




 ↑↓ ↑↓ ↑↓ ↑↓ ↑
↑↓ ↑↓ ↑↓ ↑↓ ↑
Пример 5. Изобразите электронно-графические формулы атомов углерода и железа.
Решение.
а) электронная формула атома углерода с порядковым номером шесть: 6С 1s22s22p2; электронно-графическая формула:
6C 2p
| 2 s | ↑ | ↑ | ||
| 1 s | ↑↓ | |||
| ↑↓ |
Или 1 s 2 s 2 p




 ↑↓ ↑↓ ↑ ↑
↑↓ ↑↓ ↑ ↑
Внешним является второй энергетический уровень: …2s2 2p2 и соответственно
2s 2p



 ↑↓ ↑ ↑.
↑↓ ↑ ↑.
б) Электронная формула атома железа с порядковым номером двадцать шесть: 1s2 2s2 2p6 3s23p64s23d6. Внешним является …3d64s2 и соответственно: 3d 4s





 ↑↓ ↑ ↑ ↑ ↑ ↑↓.
↑↓ ↑ ↑ ↑ ↑ ↑↓.
2.2 Химическая связь
Дата добавления: 2015-10-24; просмотров: 167 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Видих про касету | | | Существует два подхода к описанию химической связи: метод валентных связей (МВС) и метод молекулярных орбиталей (ММО). |