
Читайте также:
|
Термохимия
3.1 Термохимия
Химические реакции сопровождаются выделением или поглощением энергии. Раздел химии, изучающий энергию химических реакций, называется термохимией, а количество энергии, выделенной или поглощенной системой в ходе реакции (при Р=const, Т=const), называется тепловым эффектом реакции или энтальпией реакции - DН, измеряется в кДж/моль.
Если в результате реакции теплота выделяется (DН<0), то реакция называется экзотермической. Реакция, протекающая с поглощением теплоты (DН>0), называется эндотермической.
Уравнения процессов, в которых указаны тепловые эффекты, называются термохимическими. Тепловой эффект записывается после уравнения реакции, например:
Н2(г) + ½ О2(г) = Н2О(ж); D  = - 285 кДж.
= - 285 кДж.
Основным законом термохимии является закон Гесса:
тепловой эффект (или изменение энтальпии) реакции зависит от природы и состояния исходных веществ и конечных продуктов, но не зависит от пути реакции, т.е. от числа и характера промежуточных стадий.
Сущность закона Гесса рассмотрим на примере окисления графита до оксида углерода (IV) СО2. Этот процесс можно осуществить или сразу:
а) С(гр) + О2(г) = СО2(г); DН,
или через промежуточные стадии:
б) С(гр) +1/2О2(г) = СО(г); DН1
в) СО(г) + 1/2О2(г) = СО2(г); DН2.
По закону Гесса DН = DН1 + DН2
При расчетах энтальпии химической реакции особое значение имеют – энтальпия образования вещества и энтальпия сгорания.
Энтальпией образования вещества называется тепловой эффект образования 1моль вещества из простых веществ, устойчивых при 298К и давлении 101,3 кПа. Энтальпию образования вещества обозначают D  В или D
В или D 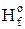 ,В.. Энтальпия образования простых веществ равна нулю.
,В.. Энтальпия образования простых веществ равна нулю.
Из закона Гесса следует, что энтальпия химической реакции равна разности между суммой энтальпий образования продуктов реакции и суммой энтальпии образования исходных веществ с учетом стехиометрических коэффициентов.
Так для модельной реакции вида
аА + bB = сС + dD, где
a, b, c, d –коэффициенты перед формулами веществ A, B, C, D.
DН = (сD 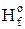 ,С +dD
,С +dD 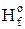 ,D) – (aD
,D) – (aD 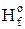 ,A +bD
,A +bD 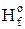 ,B).
,B).
Пример 1. Определите тепловой эффект реакции получения водорода из природного газа:
СH4(г) + 2Н2О(г) = СО2(г) + 4Н2(г)
Решение: По закону Гесса:
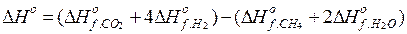
Подставляя табличные данные DНоf веществ, получим:
DНо = (-393,5+4(0)) - (-74,85+2 (-241,82)) = 164,98 кДж/моль
Данная реакция является эндотермической.
Пример 2. Определите стандартную энтальпию образования пропана С3Н8, если энтальпия реакции
С3Н8(г) + 5О2(г) = 3СО2(г) + 4Н2О(г)
равна – 2043,86 кДж.
Решение. По закону Гесса:
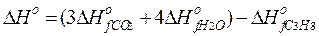
Подставляя справочные данные DНоf веществ, получаем:
 (кДж/моль).
(кДж/моль).
Реакция образования пропана относится к экзотермическим.
Энтальпией сгорания называется тепловой эффект реакции окисления одного моля вещества кислородом с образованием оксидов элементов. Обозначается DНосгор. Окисление органических соединений происходит до СО2(г) и Н2О(ж).
Для негорючих веществ теплоты сгорания равны нулю.
Энтальпия реакции равна разности между суммой энтальпий сгорания исходных веществ и суммой энтальпий сгорания продуктов реакции.
Для модельной реакции аА + вВ = сС + dД
DН0 = (аDНосгор.А + вDНосгор.В) – (сDНосгор.С + dDНосгор.D)
Зная теплоты образования, можно рассчитать теплоты сгорания и, наоборот, по теплотам сгорания легко рассчитать теплоты образования.
Пример 3. Энтальпия сгорания метанола СН3ОН равна –726,64 кДж. Пользуясь значениями энтальпий образования СО2 и Н2О, рассчитайте энтальпию образования метанола СН3ОН.
Решение. Составим термохимические уравнения реакций, выписав из таблицы энтальпии образования СО2 и Н2О:
СН3ОН + 3/2О2 = СО2 + 2Н2О + 726, 64 (а)
С + О2 = СО2 + 393,51 (б)
2 ç Н2 + ½ О2 = Н2О + 285,84 (в)
Умножая уравнение (в) на 2, суммируя его с уравнением (б) и вычитая из этой суммы уравнение (а), получим:
С + 2Н2 + ½ О2 = СН3ОН + 238,5.
Отсюда DН0f.(СН3ОН) = -238,5 (кДж/моль).
3.2 Энтропия химических реакций
Многие процессы протекают без подвода энергии от внешнего источника. Такие процессы называются самопроизвольными. Одной из движущих сил самопроизвольных процессов является уменьшение энтальпии системы (DН < 0) (энтальпийный фактор). Другая движущая сила – стремление частиц (молекул, ионов, атомов) к хаотическому движению, а системы – к переходу от более упорядоченного состояния к менее упорядоченному.
Мерой неупорядоченности состояния системы служит термодинамическая функция, получившая название энтропии – S.
Математически S = RlnW, где
W – вероятность системы;
R – универсальная газовая постоянная.
Энтропия имеет размерность Дж/(моль×К).
Энтропия реакции равна сумме энтропий продуктов реакции за вычетом суммы энтропий исходных веществ с учетом стехиометрических коэффициентов. Например, энтропия реакции:
СН4 + Н2О(г) = СО + 3Н2
при стандартных условиях равна:
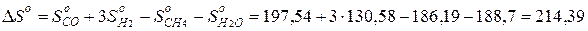
DSo=214,39 (Дж/моль×К)
Энтропия увеличивается при переходе вещества из твердого в жидкое (DSпл), из жидкого в газообразное (DSкип), а также при переходе из кристаллического состояния в аморфное. Если в результате процесса возрастает число молей газообразных веществ, то энтропия реакции также увеличивается.
Пример 4. Определите, может ли реакция:
2С(гр) + 3Н2(г) = С2Н6(г)
протекать самопроизвольно при постоянной температуре, если энтропии веществ равны (Дж/(моль×К):
 ;
;  ;
; 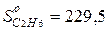 .
.
Решение. Изменение энтропии DSo химического процесса равно:
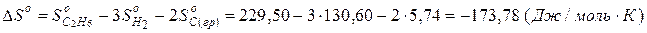 Реакция не может протекать самопроизвольно, так как DS < 0.
Реакция не может протекать самопроизвольно, так как DS < 0.
3.3 Энергия Гиббса
В любых химических процессах проявляются две тенденции: а) стремление к образованию прочных связей между частицами – энтальпийный
фактор (DH);
б) стремление к беспорядочному движению, возрастанию энтропии – энтропийный фактор (ТDS). Оба этих фактора объединяет функция, называемая энергией Гиббса (DG).
DG =DH - ТDS.
Энергия Гиббса служит критерием самопроизвольного протекания химической реакции. Химическая реакция принципиально возможна, если энергия Гиббса уменьшается, то есть DG < 0.
Если энергия Гиббса возрастает (DG > 0), реакция самопроизвольно в прямом направлении протекать не может, но возможно ее течение в обратном направлении.
Если DG = 0, то реакция может протекать как в прямом, так и в обратном направлениях, наступает состояние равновесия.
Изменение энергии Гиббса (DG) равно разности сумм энергии Гиббса продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов, т.е. 
Пример 5. Определите, возможна ли реакция
SiO2(кр) + 2NaOH(р) = Na2SiO3(кр) + H2O(ж),
если энергии Гиббса веществ равны (кДж/моль):
 ;
;  ;
;  ;
; 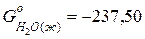
Решение. Изменение энергии Гиббса (DGо) реакции равно:
DGо =(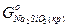 +
+ 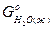 ) - (
) - (
 )
)
Подставляя численные значения, получаем:
DGо =(-1427,80-237,50) - (- 803,75-2·419,50) = - 22,55 кДж/моль.
Реакция возможна, так как DGо<0.
В соответствии с уравнением DG=DH-TDS самопроизвольному протеканию процесса способствует уменьшение энтальпийного фактора и увеличение энтропийного.
Для экзотермических реакций, когда DH<0 и в ходе реакции DS>0, DG <0 при любых температурах. Такие реакции самопроизвольно могут протекать только в прямом направлении, т.е. являются необратимыми, например:
С(гр) + ½ О2 = СО
(DH= -110кДж/моль; DS=89,18Дж/(моль·К))
Наоборот, эндотермическая реакция (DH>0), в результате которой DS<0, не может протекать самопроизвольно, например:
СО = С(гр) + 1/2О2
Если в результате реакции DH < 0 и DS < 0, то при невысокой температуре |DH| > |TDS|, реакция возможна (DG < 0). При высоких температурах |DH| < |TDS|, прямая реакция невозможна (DG > 0), а обратная возможна. Например:
CaO + CO2 = CaCO3
 DHo= -177,4 кДж/моль
DHo= -177,4 кДж/моль
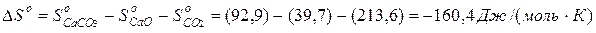
Отсюда, DGo=DH-TDS = -177,4 - 298·(160,4·10-3)= -129,6 (кДж/моль)
Реакция возможна при стандартных условиях.
Если Т = 1200К
DGo = -177,4 - 1200·(-0,1604) = 15,08 (кДж/моль)
Реакция невозможна.
Для определения температуры, выше которой происходит смена знака энергии Гиббса(DG), можно воспользоваться условием DG=0, при котором система находится в состоянии равновесия. Тогда Тр=DH/DS, где Тр- температура равновесия.
Для приведенной выше реакции смена знака энергии Гиббса происходит при:
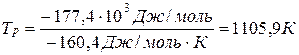
Задачи к разделу 3:
«Энергетика химических процессов.
Термохимия»
61. Определите энтальпию образования сероуглерода СS2
CS2(Г) + 3О2 = СО2(Г) + 2SО2(Г),
если известно, что: DН = 1075 кДж.
62. При взаимодействии 5 г металлического натрия с водой выделяется 40 кДж теплоты, а при взаимодействии 10 г оксида натрия Na2O с водой выделяется 36,46 кДж теплоты. Определите энтальпию образования Na2O.
63. Определите стандартную энтальпию образования Fe2O3, если при реакции
2Fe(т) + Al2O3(т) = Fe2O3(т) + 2Al(т)
на каждые 80 г Fe2O3 поглощается 426,5 кДж.
64. Определите стандартную энтальпию образования сахарозы С12Н22О11, если энтальпия реакции:
С12Н22О11(Т) + 12О2(Г) = 12 СО2(Г) + 11Н2О(Ж)
равна -5694 кДж.
65. Восстановление диоксида свинца протекает по уравнению:
РвО2(Т) + Н2(Г) = РвО(Т) + Н2О(Г) - 182,8 кДж.
Определите стандартную энтальпию образования РbО2.
66. При взаимодействии трех молей оксида азота (I) N2O с аммиаком образуется азот и пары воды. Тепловой эффект реакции равен - 877,76 кДж. Напишите термохимическое уравнение этой реакции и вычислите энтальпию образования N2O (г).
67. Определите возможность протекания реакции:
2С (графит) + Н2(г) = С2Н2 (г),
рассчитав DSо, DНo и DGo этого процесса.
68. Тепловой эффект реакции сгорания жидкого бензола с образованием паров воды и оксида углерода (IV) равен - 3135,58 кДж. Составьте термохимическое уравнение этой реакции и вычислите энтальпию образования С6Н6 (ж).
69. Определите энтальпию реакции,
2PbS(т) + 3O2(г) = 2PbO(т) + 2 SO2(г),
используя значение стандартных энтальпий образования реагирующих веществ. При какой температуре возможна эта реакция?
70. При сгорании газообразного аммиака образуются пары воды и оксид азота (II) NO (г). Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект в расчете на 1 моль NH3 (г). Определите температуру равновесия этой реакции.
71. Прямая или обратная реакция будет протекать при стандартных условиях в системе:
2NO (г) + O2 (г) Û 2NO2 (г)
Ответ мотивируйте, вычислив DG0 прямой реакции.
72. Вычислив  системы
системы
PbO2 (т)+ Pb(т) = 2PbO(т)
на основании 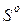 и
и  реагирующих веществ, определите, возможна ли эта реакция при стандартных условиях.
реагирующих веществ, определите, возможна ли эта реакция при стандартных условиях.
73. На основании величин  и
и 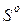 реагирующих веществ вычислите
реагирующих веществ вычислите 
реакции:
СО (г) + Н2О (г) = СО2 (г) + Н2 (г).
В каком направлении будет протекать реакция?
74. Определите тепловой эффект реакции:
CO2 (г) + 4H2 (г) = CH4 (г) + 2H2O (ж),
используя значения 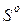 и
и  реагирующих веществ. Возможна ли эта реакция при стандартных условиях?
реагирующих веществ. Возможна ли эта реакция при стандартных условиях?
75. Определите тепловой эффект реакции
4NH3 (г) + 5O2 (г)= 4NO (г) + 6H2O (г),
используя значения 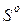 и
и  реагирующих веществ. Возможна ли эта реакция при стандартных условиях?
реагирующих веществ. Возможна ли эта реакция при стандартных условиях?
76. Эндотермическая реакция взаимодействия метана с оксидом углерода (IV) протекает по уравнению
CH4 (г) + CO2 (г) = 2CO (г) + 2H2 (г); DН= +247,37 кДж.
При какой температуре начнется эта реакция?
77. Вычислите, при какой температуре начнется диссоциация PCl5, протекающая по уравнению:
PCl5 (г) = PCl3 (г) + Cl2 (г); DН= +92,59 кДж.
78. Укажите, какая из двух реакций будет протекать самопроизвольно:
а) Fe (т) + Al2O3 (т) = Al(т) + Fe2O3 (т)
б) Al (т)+ Fe2O3 (т) = Fe(т) + Al2O3 (т)
79. Образование H2S из простых веществ протекает по уравнению:
Н2(Г) + S(РОМБ.) = Н2S(Г); DН = 20,15 к/Дж
Определите  и
и  для этой реакции.
для этой реакции.
80. Получение СО2 из простых веществ идёт по уравнению:
С(К) + О2(Г) = СО2(Г); DН = −393,51 к/Дж
Определите  и
и  для этой реакции.
для этой реакции.
Раздел 4
Дата добавления: 2015-10-24; просмотров: 178 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Существует два подхода к описанию химической связи: метод валентных связей (МВС) и метод молекулярных орбиталей (ММО). | | | Химическое равновесие |