
|
Читайте также: |
1. Метод валентных связей исходит из того, что химическая связь осуществляется связывающими электронными парами, каждая из которых принадлежит двум атомам. Связывающие электронные пары могут образовываться по обменному или донорно-акцепторному механизму.
1.1. По обменному механизму связь возникает за счет перекрывания электронных орбиталей неспаренных электронов двух атомов. В связывающей электронной паре электроны имеют антипараллельные спины.
Пример 1. Покажите, какие орбитали и как участвуют в образовании химиче- ской связи в молекулах: а) Li2; б) LiF; в) F2. Напишите графические формулы этих молекул.
Решение: Электронные формулы атомов лития и фтора имеют вид:
3Li 1s22s12p0 9F 1s22s22p5
и электронно-графические формулы их соответственно:
2s 2p 2s 2p







 ↓ ↑↓ ↑↓ ↑↓ ↑
↓ ↑↓ ↑↓ ↑↓ ↑
Li F
Неспаренный электрон атома лития занимает 2s-орбиталь, а атома фтора 2p-орбиталь. Следовательно, эти орбитали участвуют в образовании химической связи вышеприведенных соединений. Это можно представить:
 |  |
Li-Li Li-F
 |
F-F
Число связей, которые образует атом по обменному механизму, как правило, равно числу его неспаренных электронов в основном или валентно-возбужденном состоянии. В методе валентных связей исходят из того, что валентно-возбужденные состояния атома, отличающиеся от основного большим числом неспаренных электронов, получают переводом одного или нескольких электронов электронных пар на свободные орбитали другого подуровня того же электронного уровня.
Пример 2. Сколько связей по обменному механизму могут образовать атомы серы и кислорода? Напишите эмпирические формулы их соединений со фтором.
Решение. Кислород с порядковым номером восемь является элементом 2-го периода. Электронная формула 8О 1s22s22p6. На валентном уровне атом имеет 4 орбитали и 6 электронов:
2s 2p



 ↑↓ ↑↓ ↑ ↑
↑↓ ↑↓ ↑ ↑
В валентном электронном уровне атома кислорода нет вакантных орбиталей. Следовательно, атом кислорода может образовать по обменному механизму только две связи. Соединение со фтором имеет формулу ОF2 и соответственно графическую F-O-F.
Сера с порядковым номером шестнадцать – элемент 3-го периода. Электронная формула 1s22s22p63s23p4.
Валентный уровень серы состоит из 3-х подуровней и 9 орбиталей.
Атом серы может иметь два валентно-возбужденных состояния.
3s 3p 3d








 ↑↓ ↑↓ ↑ ↑
↑↓ ↑↓ ↑ ↑
3s 3p 3d









 ↑↓ ↑ ↑ ↑ ↑ сера (IV)
↑↓ ↑ ↑ ↑ ↑ сера (IV)
3s 3p 3d








 ↑ ↑ ↑ ↑ ↑ ↑ сера (VI).
↑ ↑ ↑ ↑ ↑ ↑ сера (VI).
Она может образовывать 2, 4 и 6 связей по обменному механизму.
Соединения серы со фтором имеют формулы SF2; SF4; SF6.
Связи между атомами могут быть кратными (двойными, тройными). Кратные связи образуются с участием σ- и π- связей.
Пример 3. Покажите, какие орбитали и как участвуют в образовании связи в молекуле С2. Напишите графическую формулу молекулы С2.
Решение. Электронная конфигурация атома углерода с порядковым номером шесть 6С 1s22s22p2 и соответственно электронно-графическая формула имеет вид:
2s 2p



 ↑↓ ↑ ↑
↑↓ ↑ ↑
В образовании связей у каждого атома углерода могут участвовать два р-электрона (Рх, Ру): одна связывающая электронная пара образует σ-связь (Рх-Рх), другая π (Ру-Ру)
 p
p
+ +
С С
|

Связь может образоваться за счет неподеленной пары электронов одного атома и свободной орбитали другого атома. Атом, представляющий для образования
 связи электронную пару, называется донором (Д), а атом, имеющий свободную орбиталь, называется акцептором (А).
связи электронную пару, называется донором (Д), а атом, имеющий свободную орбиталь, называется акцептором (А).
Д + А = Д А
Например, образование иона аммония:
2s 2p, 1s 




 ↑↓ ↑ ↑ ↑ ¯
↑↓ ↑ ↑ ↑ ¯
N H 
N + 3H ® NH3
|




















 Н N +H+ = H N Н
Н N +H+ = H N Н
|
|

Д А
Геометрическую структуру молекул, направленность ковалентных связей определяет теория гибридизации атомных орбиталей центрального атома.
Гибридизация – это перераспределение электронной плотности между разными, но близкими по энергии атомными орбиталями одного энергетического уровня и образование гибридных атомных орбиталей, численно равных количеству исходных и одинаковых по форме и по энергии.
 Например, в гибридизации могут участвовать s- и p-орбитали одного энергетического уровня, обладающие различной симметрией. В результате образуются две гибридные орбитали. Гибридные атомные орбитали (ГАО) имеют несимметричную форму. У таких орбиталей электронная плотность по одну сторону выше, что и определяет перекрывание электронных облаков и делает более устойчивой химическую связь.
Например, в гибридизации могут участвовать s- и p-орбитали одного энергетического уровня, обладающие различной симметрией. В результате образуются две гибридные орбитали. Гибридные атомные орбитали (ГАО) имеют несимметричную форму. У таких орбиталей электронная плотность по одну сторону выше, что и определяет перекрывание электронных облаков и делает более устойчивой химическую связь.

Типы гибридизации атомных орбиталей
1. Комбинация одной s и одной p-орбиталей приводит к sp-гибридизации. Образуются два гибридных облака, ориентированных в пространстве под углом 1800.
Например, образование молекулы ВеСl2:
 |
1s22s2 
 *Be 1s22s12p1 (перевод в возбужденное состояние). В результате гибридизации 2s и 2p орбиталей образуется линейная связь и линейная молекула
*Be 1s22s12p1 (перевод в возбужденное состояние). В результате гибридизации 2s и 2p орбиталей образуется линейная связь и линейная молекула
 Cl Be Cl
Cl Be Cl
1800
Элементы II группы, подвергаясь sp-гибридизации, образуют линейные молекулы.
2. Комбинация одной s- и двух p-орбиталей приводит к sp2-гибридизации.
Например, образование молекулы ВН3.
5В 1s22s22p1  B* 1s22s12p2. В результате гибридизации одной s- и двух p- орбиталей образуется треугольная плоская молекула.
B* 1s22s12p2. В результате гибридизации одной s- и двух p- орбиталей образуется треугольная плоская молекула.
 |

Элементы III группы, подвергаясь sp2-гибридизации, образуют треугольные плоские молекулы.
3. Комбинация одной s- и трех p- орбиталей приводит к sp3- гибридизации.
 |
6С 1s22s22p2  C* 1s22s12p3
C* 1s22s12p3
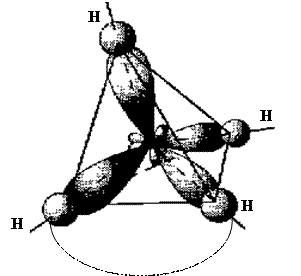 В результате гибридизации одной s- и трех p-орбиталей образуется тетраэдрическая молекула.
В результате гибридизации одной s- и трех p-орбиталей образуется тетраэдрическая молекула.
1090 28¢
Элементы IV группы, подвергаясь sp3-гибридизации, образуют тетраэдрические молекулы.
Задачи к разделу 2:
«Строение атома. Химическая связь»
2.1 Строение атома
21. Составьте электронные формулы и укажите значения квантовых чисел n и l для внешних электронов в атомах элементов с порядковыми номерами 14, 23, 35.
22. Объясните, какие квантовые числа определяют размер, форму и ориентацию в пространстве электронной орбитали. Приведите примеры.
23. Определите максимальное число электронов, находящихся на третьем и четвёртом энергетическом уровнях. Приведите электронные формулы соответствующих атомов.
24. Напишите электронные формулы и изобразите электронно-графическую схему распределения электронов в атомах с порядковыми номерами 46, 55.
25. Напишите электронные формулы атомов хрома и меди. Объясните нахождение одного s-электрона на четвёртом энергетическом уровне.
26. Энергетическое состояние внешнего электрона описывается следующими значениями квантовых чисел: n = 4, l = 0, ml = 0. Атомы, каких элементов имеют такой электрон? Напишите электронные формулы атомов этих элементов.
27. Для атома возможны два электронных состояния: 1s22s22p63s23p2 и 1s22s22p63s13p3. Как перейти от первого состояния ко второму? Назовите эти состояния и соответствующий атом, его положение в периодической системе.
28. Напишите электронные формулы элементов с порядковыми номерами 24 и 53. По электронной формуле определите их положение в периодической системе (период, группу, подгруппу). Представьте их электронно-графические схемы.
29. Укажите, атомы каких элементов имеют следующее строение внешнего и предвнешнего энергетических уровней: …3s2 3p3, …3d10 4s2 4p5, 4d7 5s2.…4p6. Составьте электронные формулы.
30. Пользуясь правилом Гунда, распределите электроны по орбиталям, соответствующим низшему энергетическому состоянию, для элементов с порядковыми номерами 23, 33, 52.
31. Изобразите электронно-графическую формулу атома элемента с порядковым номером 40 и укажите число электронных пар и неспаренных электронов в атоме этого элемента в нормальном состоянии.
32. Укажите, положение элементов в периодической системе элементов Д.И.Менделеева (период, группу, подгруппу), имеющих следующие электронные формулы: а) 1s22s22p63s23p3, б) 1s22s22p63s23p64s23d2, в) 1s22s22p63s23p64s23d104p5.
33. Напишите электронные и электронно-графические формулы атомов элементов: калия, никеля, магния. К какому типу элементов они относятся (s-, p-, d-, f- элементам)?
34. Напишите электронные и электронно-графические формулы для ионов: Fe3+, S2-, Br¯, Cr3+.
35. С точки зрения теории строения атома объясните изменение свойств элементов в пределах периода и группы.
36. Напишите электронные и электронно-графические формулы электронных оболочек ионов: Cu2+, Cl-, Mg2+.
37. Объясните, почему свойства таких элементов, как азот и висмут, неон и магний резко отличаются друг от друга. Составьте их электронные формулы.
38. Из двух элементов один образует ион Э2+, а другой – Э2-. Оба иона имеют одинаковую конфигурацию, которая выражается формулой 1s22s22p63s23p6. Определите период, группу, подгруппу и порядковый номер каждого элемента.
39. Определите, отличаются ли два элемента числом валентных электронов и характером химических свойств по окончаниям их электронных формул: а) …3d24s2 и …4s24p2; б)… 4d105s25p3 и …4d55s1.
40. Ионизационный потенциал какого из двух элементов должен быть большей величиной, если электронная структура их атомов выражается следующими формулами: а) 1s22s22p5 и 1s22s22p2, б) 1s22s22p63s23p64s2 и 1s22s22p63s23p63d104s1.
2.2 Химическая связь
41. По конфигурации внешнего энергетического уровня атома фосфора укажите, какую валентность может проявлять фосфор и какие атомные орбитали участвуют в образовании молекул: PCl3, PCl5, H[PCl6]. Приведите схемы их образования.
42. Изобразите графически образование связей в молекулах: SiCl4, OF2, C2H2Cl2. Какова пространственная структура этих молекул?
43. Изобразите графически образование связей в молекулах NCl3 и C2H4. В каком состоянии (нормальном или возбужденном) находятся атомы азота и углерода при образовании молекул?
44. Изобразите графически образование связей в молекулах H2S и C2Cl4. Определите число s- и p-связей в этих молекулах.
45. Объясните, почему однотипные по атомному составу молекулы CO2 и SO2 имеют разную пространственную конфигурацию. Представьте схемы их образования.
46. Изобразите графически образование связей в молекулах AsH3 и BBr3. Какую геометрическую конфигурацию имеют эти молекулы?
47. В молекуле COCl2 атом углерода образует четыре связи при sp2- гибридизации его орбиталей. Покажите графически образование связей в этой молекуле и объясните разницу в числе связей и числе гибридных орбиталей.
48. Объясните, почему однотипные по атомному составу молекулы BCl3 и PCl3 имеют разную геометрическую конфигурацию. Приведите схему их образования.
49. Приведите три примера, когда один и тот же элемент образует ионную, полярную и неполярную ковалентные связи.
50. Пользуясь таблицей электроотрицательностей, определите характер связей: K-F, H-O, H-P, C-F.
51. Объясните, почему максимальная валентность фосфора может быть равной пяти, а у азота такое валентное состояние отсутствует.
52. Расположите в порядке возрастания степени ионности связи: Mg-Cl, C-S, Br-J, B-F.
53. Укажите, какая из молекул PF3 или PJ3 более прочная. Дайте объяснение.
54. Определите, к атомам каких элементов смещены общие электронные пары, осуществляющие химическую связь, в молекулах: NaCl, H2O, BF3, CO2. (пользуясь таблицей электроотрицательностей).
55. Объясните, почему максимальная валентность у серы может быть равной шести, а у кислорода такое валентное состояние отсутствует.
56. Приведите примеры молекул, которые содержат: а) только s-связи; б) одну s- и одну p-связи; в) две s- и две p-связи.
57. Изобразите графически образование связей в молекулах CF4, AsH3, C2Cl4. Какова пространственная структура этих молекул?
58. Приведите примеры молекул, которые содержат: а) четыре s- и одну p-связи; б) одну s- и две p-связи.
59. Укажите, какой тип гибридизации атомных орбиталей имеет место при образовании молекул BeF2, BJ3, SiH4. Представьте схему их образования и пространственную структуру.
60. Изобразите графически образование связей в молекулах H2S и C2F4. Определите число s- и p-связей в этих молекулах.
Раздел 3
Дата добавления: 2015-10-24; просмотров: 568 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Строение атома. Химическая связь | | | Энергетика химических процессов. |