
Читайте также:
|
8.1 РАСТВОРЫ— гомогенные (однородные) системы, то есть каждый из компонентов распределён в массе другого в виде молекул, атомов или ионов.(Газообразные, жидкие, твердые)
Жидкий р-а-состоит из жидкости
8.2 Раствори́мость — способность вещества растворятся в том или ином р-ре
Классификация растворов (по содержанию растворенного вещества, по агрегатному состоянию).Насыщенный раствор – термодинамически устойчивая равновесная система, в которой скорость растворения вещества равна скорости выделения его из раствора. Ненасыщенный раствор – термодинамически устойчивая неравновесная система, в которой концентрация вещества меньше, чем в насыщенном растворе, и поэтому скорость растворения больше скорость выделения. Пересыщенный раствор – термодинамически неустойчивая псевдоравновесная система, в которой концентрация вещества больше, чем в насыщенном растворе, и поэтому скорость выделения больше скорости растворения. Концентрированный раствор – раствор с высоким содержанием растворенного вещества.Разбавленный – с низким содержанием растворенного вещества. Гомогенные растворы – истинные растворы. Гетерогенные растворы – коллоидные растворы
Коэффициент растворимости – характеристика раствора, означающая число единиц массы безводного вещества, насыщающего при данных условиях 100 единиц массы растворителя. Измеряется в m (г) вещества на 100 г растворителя.
8.3Концентрация — величина, характеризующая количественный состав раствора. 
 Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах. Формула молярной концентрации Cm = n / V, где n - это количество ратсворенного вещества (моль),V - объем раствора
Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах. Формула молярной концентрации Cm = n / V, где n - это количество ратсворенного вещества (моль),V - объем раствора
Массовая концентрация вещества-Масса растворенного вещества, находящаяся в единице объема раствора.
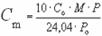 , (г/м3)
, (г/м3)
8.4Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении.
Электроли́т — вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы, однако само вещество электрический ток не проводит. Примерами электролитов могут служить растворы кислот, солей и оснований.
Дата добавления: 2015-10-29; просмотров: 106 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Общественная формация, ее состав и структура. стр118 | | | Движение и развитие. Из единство и различие. |