
|
Читайте также: |

4. Прямое гидроксилирование. Катализаторами служат соли металлов Fe (II), Cu (II), Ti (III).

5. Окисление изопропилбензола (кумола) –метод Сергеева-Удриса, используемый в промышленности.

Физические свойства спиртов и фенолов. Особенности их строения.
Спирты и фенолы имеют более высокие температуры кипения (Ткип.)
и плавления (Тпл.), чем соответствующие им углеводороды и галогеноводороды.
Сопоставляя Ткип. метана СН4 (-161оС), хлорметана СН3Сl (-24 оС) и метанола СН3OH (+64,7 оС) можно заметить аномально высокие температуры кипения спиртов и фенолов, что объясняется образованием межмолекулярных водородных связей в этих соединениях.

Спирты образуют водородные связи и с молекулами воды.
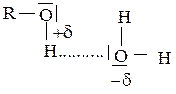
Поэтому низшие спирты хорошо растворимы в воде, но с ростом молекулярной массы растворимость спиртов уменьшается вследствие уменьшения влияния водородных связей.
Фенолы – высококипящие жидкости или низкоплавкие соединения.
Фенол заметно растворим в воде.
Ассоциация молекул спирта и фенола за счет водородных связей определяется высокой полярностью связи О−Н из-за сильного различия в электроотрицательности атомов кислорода и водорода (3,5 и 2,1 соответственно).
Спирты и фенолы полярные соединения. Дипольный момент спиртов составляет 1,6-1,8 D.

Фенолы имеют дипольный момент 1,5- 1,6 D, и он (в отличие от алканолов) направлен в сторону бензольного кольца.

Некоторые физические константы спиртов приведены в Таблице 1, фенолов в Таблице 2.
Таблица 1. Ряд спиртов, номенклатура, некоторые физические свойства.
| Формула | Номенклатура | Тпл, О С | Ткип, ОС | Плотность d4 20 | Растворимость, г/100 г Н2О | |
| научная | тривиаль- ная | |||||
| СН3ОН | метанол | метило- вый спирт | -97 | 64,5 | 0,793 | ∞ |
| СН3СН2ОН | Этанол | этиловый спирт | -117 | 78,3 | 0,789 | ∞ |
| СН3СН2СН2ОН | пропанол | пропило-вый спирт | -127 | 97,2 | 0,804 | ∞ |
| СН3СНОНСН3 | 2-пропа-нол | изопропиловый спирт | -88,5 | 82,3 | 0,785 | ∞ |
| СН3(СН2)3ОН | бутанол | н-бутило-вый спирт | -89,5 | 0,810 | 7,9 | |
| (СН3)2СНСН2ОН | 2-метил-1-пропанол (2-метил-пропан-1ол) | изобутиловый спирт | -108 | 108,4 | 0,802 | 10,2 |
| СН3СН2СНОНСН3 | 2-бутанол | вторбутиловый спирт | -114 | 99,5 | 0,806 | 12,5 |
| (СН3)3СОН | 2-метил-2-пропанол | третбутиловый спирт | 25,5 | 0,788 | ∞ | |
| СН3(СН2)3СН2ОН | 1-пентанол | амиловый спирт | -78,5 | 0,814 | 2,3 | |
| (СН3)2СНСН2СН2ОН | 3-метил-1-бутанол | изоамиловый спирт | -117 | 130,5 | 0,812 | |
| Цикло-С6Н111ОН | циклогексанол | 161,5 | 0,962 | ~4 | ||
| СН2=СНСН2ОН | 2-пропен-1-ол | аллиловый спирт | -129 | 0,852 | ∞ | |

| бензиловый спирт | -15 | 205,8 | 1,046 | ||
| (С6Н5)3СОН | трифенилкарбинол | 162,5 | н/р |
Таблица 2. Ряд фенолов, номенклатура, некоторые физические константы.
| Формула | Название | Тпл, О С | Ткип, ОС | рКа | Растворимость, г/100 г Н2О |

| Фенол | 9,3 | |||

| о-хлорфенол | 9,1 | 2,8 | ||

| о-нитрофенол | 7,2 | 0,2 | ||

| м-нитрофенол | 8,4 | 1,4 | ||

| п-нитрофенол | 7,1 | 1,7 | ||

| 2,4,6-тринитрофенол (пикриновая кислота) | 1,0 | 1,4 | ||

| о-крезол | 10,2 | 2,5 | ||
| м-крезол | 10,1 | 2,6 | ||

| п-крезол | 10,2 | 2,3 | ||

| пирокатехин | 9,4 | |||

| резорцин | 110,8 | 9,4 | ||

| гидрохинон | 169-171 | 10,0 |
Сравнение кислотно-основных свойств спиртов и фенолов
Спирты не обладают ярко выраженными кислотными или основными свойствами и являются практически нейтральными соединениями, в незначительной степени проявляющими амфотерные свойства.

Электронодонорная алкильная группа повышает отрицательный заряд на атоме кислорода и диссоциация ОН-связи проходит в меньшей степени чем в молекуле воды (для спиртов рКа ≈18, для воды рКа =15,7).
Поэтому спирты (проявляя очень слабые кислые свойства) реагируют только со щелочными и активными металлами и не реагируют со щелочами.

Алкоголяты являются сильными основаниями и сильными нуклеофильны-ми реагентами. Кислотные свойства спиртов убывают в следующем порядке:
первичные > вторичные >третичные.
Спирты (как и вода) проявляют и основные свойства. Они реагируют на холоду с сильными кислотами, образуя соли алкилоксония (которые превращаются в галогенопроизводные).

Основные свойства спиртов убывают в противоположном порядке по сравнению с кислотными.
Фенолы проявляют значительно большую кислотность, чем спирты или вода, однако, как кислоты, они слабее, чем угольная и карбоновые кислоты.
Увеличение кислых свойств фенолов связано с положительным мезомерным эфекфтом (+М), в результате которого в ароматическое кольцо смещается электронная плотность от кислорода, что в свою очередь, еще больше способствует поляризации ОН-группы.

Образование фенолят аниона выгоднее, чем алкоголят-аниона, так как происходит образование устойчивого стабилизированного резонансом аниона.

Резонансные структуры фенолят аниона.
Фенол (рКа=10) на 8 порядков обладает более кислыми свойствами, чем циклогексанол (рКа=18). Фенол в отличие от спиртов реагирует не только со щелочными металлами, но и со щелочами с образованием солей - фенолятов.

Из данных Таблицы 2 видно, что введение в ароматическое ядро фенола электронодонорных заместителей уменьшает кислотность, а введение
электроноакцепторных увеличивает.
Химические свойства
Спирты и фенолы по природе своей функциональной группы относятся к числу нуклеофильных реагентов, причем спирты являются более сильными нуклеофилами, чем фенолы.
В общем виде для соединений типа R-OH возможно прохождение реакций как

Химические свойства спиртов
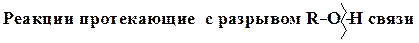
1. Спирты (как кислоты) реагируют с активными и щелочными металла - ми (Na, K, Mg, Al и др.)


Дата добавления: 2015-10-23; просмотров: 265 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Спирты. Фенолы. | | | Окисление спиртов |