
Читайте также:
|
Применение реакций гетероциклизации будет рассмотрено на примере получения лекарственных препаратов, имеющих трех-, четырех-, пяти-, шести- и семичленные циклы, а также конденсированные системы.
Препараты, имеющие трехчленный цикл. В качестве сырья при получении препаратов широко используют оксираны – этиленоксид и пропиленоксид. Их получение рассмотрено в разделе 2.6, схема получения: 2 + 1. При синтезе фенилэфрина для введения метиламиногруппы в качестве промежуточного продукта синтезируют оксид м -нитростирола:

В данном случае в молекуле уже имеется трехатомный фрагмент, который под действием щелочи циклизуется. Получение препарата фенилэфрин рассмотрено также в разделах 2.4, 2.1.1, 2.1.5.
Для лечения злокачественных новообразований в качестве алкилирующих средств наряду с производными бис(b-хлорэтил)амина используют производные этиленимина (азиридина). В молекуле митомицина имеется азиридиновый цикл. Антибиотик продуцируется культурами грибов Streptomyces caespitosus. Препарат используется в химиотерапии диссеминированной аденокарциномы желудка и поджелудочной железы, рака шейки матки, рака молочной железы, легкого, пищевода, кишечника.
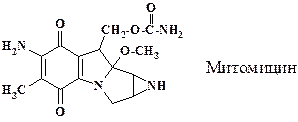
В препарате тиотэф имеются три остатка этиленимина. Получение и формула препарата приведены на схеме:

При взаимодействии хлорэтиламина со щелочью из реакционной массы отгоняют этиленимин. При работе с ним необходимо соблюдать максимальную осторожность, т. к. это соединение высокотоксично (LD100 5 – 10 мг/кг) и является супермутагеном. Тиофосфорилхлорид реагирует с этиленимином в бензоле в присутствии триэтиламина. Это лекарственное средство используется для лечения рака молочной железы, хронического лимфолейкоза, миелолейкоза и лимфосаркомы. Аналогично получают препарат бензотэф из бензамида, тиофосфорилхлорида и этиленимина.
Препараты, имеющие четырехчленный цикл. Синтез гетероциклических соединений, имеющих напряженный четырехчленный цикл, осуществляются по схеме 2 + 2, а также циклизацией четырехатомного скелета.

При пиролизе ацетона наряду с кетеном образуется его димер – дикетен. При взаимодействии кетена (формальная схема 2 + 2) с кетонами получают b-лактоны, а с азометинами b-лактамы.
Антибиотики пенициллинового и цефалоспоринового ряда содержат b-лактамный цикл. В качестве примера приведены формулы полусинтетических антибиотиков оксациллин и цефазолин. Первый применяют для лечения инфекций, вызванных стафилококками, устойчивыми к феноксиметилпенициллину. Цефазолин активен против большинства грамположительных кокков, устойчивых к пенициллинам, а также против ряда грамотрицательных бактерий. Этот препарат угнетает транспептидазу и препятствует образованию поперечных сшивок пептидгликана.

Препараты получают с помощью ацилирования аминогруппы цефалоспорановой и аминопенициллановой кислот.
Синтетический b-лактамный антибиотик азтреонам имеет только один цикл. Механизм действия препарата тот же, что и пенициллинов и цефалоспоринов, однако он активен и против резистентных к ним микроорганизмов. Применяют это лекарственное средство при генерализованных инфекциях, кроме того, азтреонам не вызывает аллергических реакций у больных, чувствительных к другим b-лактамам. Синтез представлен на схеме:
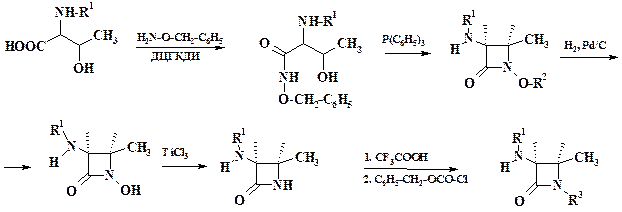
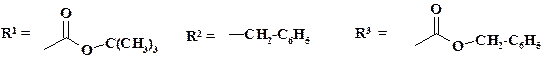
В синтезе препарата используются методы химии пептидов (раздел 3.1). При замыкании лактамного цикла применяют оригинальный прием – взаимодействие спирта с трифенилфосфитом. Образующийся фосфонат является легкоудаляемой группой, облегчающей нуклеофильную атаку замещенной аминогруппы. Элиминирование N -гидроксигруппы осуществляют с помощью треххлористого титана. Продолжение синтеза приведено в разделе 3.1.
Препараты, имеющие пятичленный цикл. При выборе схемы синтеза используют комбинации фрагментов 1 + 4, 2 + 3, а также проводят циклизацию синтезированного пятиатомного фрагмента. Имеются примеры многокомпонентной циклизации 1 + (1)2 + 2.
При получении гипотензивного препарата дибазол (бендазол) применяют для циклизации схему 4 + 1. Соединением, дающим четырехатомный фрагмент, является о- фенилендиамин, а одноуглеродным фрагментом фенилуксусная кислота:

Вместо фенилуксусной кислоты могут быть использованы фенилацетамид или цианистый бензил. Конденсацией нафтилуксусной кислоты (одноатомный фрагмент цикла) и этилендиамина (четырехатомный фрагмент) получают препарат нафтизин (раздел 2.2.2). При получении метронидазола синтез 2-метил-4,5-дигидроимидазола также проводят по схеме 4 + 1 из этилендиамина и уксусной кислоты (полная схема получения препарата приведена в разделе 2.6). Гетероциклизация по схеме 4 + 1 используется при синтезе клофелина (клонидин):

Одноатомный фрагмент – N,N -диметилдихлорметилениммоний хлорид получают хлорированием диметилтиурамдисульфида газообразным хлором. При взаимодействии с 2,6-дихлоранилином и далее с этилендиамином образуется клонидин. Препарат возбуждает a-адренорецепторы, понижает тонус сосудодвигательного центра продолговатого мозга, понижает внутриглазное давление. Применяют при гипертонических кризах, артериальной гипертензии и инфаркте миокарда в острый период. Аналогично получают имидазолиновый цикл в препарате моксонидин (физиотенз). Этот препарат действует по тому же механизму, но более длительно и мягко.
Введение одноатомного фрагмента – атома азота – в линейную молекулу с четырехатомным фрагментом с одновременной циклизацией можно рассматривать как схему 4 + 1 или циклизацию пятиатомного скелета молекулы. Этот метод является общим для синтеза 1,2,3-триазолов и 1,2,3-тиадизолов:

Процесс, с точки зрения механизма, относится к реакциям гетероэлектроциклизации и только формально его можно отнести к превращениям 4 + 1, т. к. реакция является синхронной. Другие реакции этого типа, не являющиеся синхронными, подробно рассмотрены в разделе 2.4. Пока этот метод не нашел своего промышленного применения в синтезе лекарственных веществ.
Синтез препарата коразол, осуществляемый введением атома азота в молекулу гидразидина капролактама, приведен в разделе 2.2.1.
Наиболее целесообразно синтез 2-аминотиазола, являющегося промежуточным продуктом при получении аминитрозола (нитазола) и норсульфазола (раздел 2.1.4), проводить по схеме 2 + 3. Биологическое действие и применение нитазола приведены в разделе 2.1.1. В качестве трехатомного фрагмента используют тиомочевину, двухатомного фрагмента – 2-хлорацеталь-дегид либо его полуацеталь. Гетероциклизацию проводят в водном растворе при температуре 60 oС. Однако из-за невысокой чистоты хлорацетальдегида, либо его полуацеталя, чистый 2-аминотиазол выделяют в виде соли с азотной кислотой (см. раздел 2.1.1).

Рассмотренный процесс является примером одного из общих методов синтеза производных тиазола (реакция Ганча). Реакция заключается во взаимодействии a-галогенкетонов и альдегидов с производными тиоамидов:

Вместо a-галогенкетонов и a-галогенальдегидов можно использовать также и a-диазокетоны и a-галогенкислоты.
При синтезе анальгина (метамизол натрия) на первой стадии происходит циклизация этилового эфира ацетоуксусной кислоты с фенилгидразином (раздел 2.2.1) с образованием антипирина. При получении 3-амино-4,5-ди-гидропиразола проводят конденсацию гидразина с акрилонитрилом:
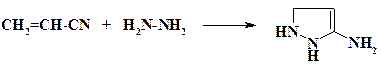
Дегидрирование этого соединения дает 3-аминопиразол (раздел 2.6).
Схему 2 + 3 применяют также и при получении производных изоксазола. Более подробно следует остановиться на принципах синтеза изоксазолов. Анализ структуры молекулы 3-фенил-4-карбоэтокси-5-метилизоксазола показывает наличие двух синтонов. Их химическими эквивалентами являются ацетоуксусный эфир и оксим бензальдегида. Для проведения реакции конденсации необходимо активировать оба компонента. Бензальоксим с помощью хлорирования превращают в хлорбензальоксим, а ацетоуксусный эфир переводят в натриевую соль.

При циклизации образуется новая С-С связь и отщепляется вода.
Также не совсем обычная схема 2 + 3 используется при получении препарата феникаберан, обладающего спазмолитическим и коронарорасширяющим действием:

При конденсации п- бензохинона с бензоилуксусным эфиром образуется 2-фенил-3-карбоэтокси-5-гидроксибензофуран. По реакции Манниха вводят в четвертое положение цикла диметиламинометиленовую группировку.
Известна трехкомпонентная циклизация 1 + (1)2 + 2, при которой образуется смесь производных имидазола:

Компонентами циклизации являются фруктоза, формальдегид и аммиак. К раствору инвертированной сахарозы добавляют параформ, раствор аммиака и сульфат меди. Выделяется комплекс производных имидазола с одновалентной медью. После разложения медного комплекса из реакционной массы добавлением пикриновой кислоты выделяют в виде пикрата 4-гидроксиметил-имидазол, разложение которого дает основание. При окислении реакционной массы азотной кислотой получены индивидуальные 4-имидазолкарбоновая, 4,5-имидазолдикарбоновая и 4-имидазолглиоксиловая кислоты. Из имидазол-4-карбоновой кислоты синтезируют 5-нитроимидазол-4-карбоновую кислоту (см. раздел 2.1.1), полупродукт в альтернативном экономически более выгодном синтезе АИКА и дакарбазина.
Циклизацию пятиатомного фрагмента применяют при получении препарата ацетазоламид (диакарб). Препарат применяют как диуретическое и противоглаукоматозное средство, а также для лечения эпилепсии. Процессы получения ацетазоламида приведены на схеме.

На первой стадии синтеза из гидразин сульфата образуется тиосемикарбазид. В реакционной массе это соединение реагирует в воде при 100 oС со второй молекулой роданистого аммония, давая гидразодикарботиоамид. В концентрированной серной кислоте происходит его циклизация в 2-амино-5-меркап-тотиадиазол, который при нагревании окисляется до соответствующего дисульфида. Серная кислота является конденсирующим и окисляющим агентом. Аминогруппу ацилируют уксусным ангидридом, для получения сульфохлорида проводят окислительное хлорирование дисульфидной группы хлором в соляной кислоте (см. раздел 2.1.4). Образующийся сульфохлорид превращают в сульфаниламид в водном аммиаке.
Промышленным методом получения производных бензотиазола является окисление фенилтиокарбамата. Сера в данной реакции является циклизующим агентом и окислителем.

Целевой продукт – 2-меркаптобензотиазол – производится в больших масштабах и используется в качестве ускорителя вулканизации.
Одним из методов синтеза производных 2-аминобензотиазола является окисление галогенами производных фенилтиомочевины. В частности, при получении противогрибкового препарата амиказол (димазол) замыкание бензотиазольного цикла осуществляют окислением замещенной фенилтиомочевины бромом. Синтез препарата представлен на схеме:

В данном синтезе этильная группа выполняет роль защитной, ее гидролиз проводят в 40 % HBr. Образующийся гидроксибензотиазол переводят в натриевую соль гидроксидом натрия в толуоле. Алкилируют соль в том же растворе b-диэтиламиноэтилхлоридом.
На первый взгляд, необычным методом циклизации является образование бензофуроксана (N -оксид бензоксадиазола) из о- нитроанилина при его окислении. Бензофуроксан применяют при получении антибактериальных препаратов хиноксидин и диоксидин, действующих против широкого круга микроорганизмов, резистентных к антибиотикам. Синтез фуроксана приведен на схеме:
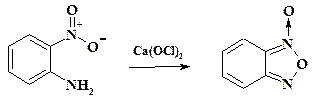
Полная схема синтеза препарата хиноксидин приведена ниже.
При получении препарата пирроксан (биологическое действие рассмотрено при описании его синтеза) используют промежуточный продукт – 3-фенипирролидин. Алкилированием СН-активного соединения цианистого бензила этиленхлоргидрином в сухом диметилформамиде в присутствии КОН получают фенильное производное нитрила g-гидроксимасляной кислоты. Восстановление водородом при давлении 0,5 МПа в спиртовом аммиаке в присутствии никеля Ренея позволяет получить пятиатомный скелет цикла. Затем проводят замену гидроксигруппы на бром и циклизуют полученный продукт в присутствии щелочи.

Широко представлены в синтезе лекарственных препаратов соединения, содержащие индольный цикл. В основу их синтеза положена реакция Фишера:

Гидразоны (шестиатомный скелет) при нагревании в присутствии циклизующего агента превращаются в гидразосоединения, расщепление которых по связи N-N приводит к получению пятиатомного скелета цикла. Образование индола идет с отщеплением аммиака. Эта реакция используется при получении антиаллергического препарата мебгидролина (диазолин). Из гидрохлорида фенилгидразина и гидрохлорида 1-метилпиперидона-4 получают гидразон, который не выделяется из реакционной массы и при кипячении в спирте превращается в целевой продукт.

Диазолин препятствует стимуляции гистамином рецепторов Н1, тем самым снижает тонус гладкой мускулатуры. Уменьшает проницаемость капилляров и развитие отека. Аналогично синтезируют другие препараты индольного и карбазолидинового ряда.
Производные фурана получают в основном из фурфурола (см. раздел 2.1.1).
Препараты, имеющие шестичленный цикл. При гетероциклизации с получением шестичленных циклов используют схемы 1+5, 2+4, 3+3, замыкание шестиатомной цепочки и многокомпонентные конденсации.
Примером гетероциклизации с введением одноуглеродного фрагмента является получение гипоксантина из АИКА.
Препарат аллопуринол является антиметаболитом гипоксантина, ингибирует ксантиноксидазу и нарушает превращение гипоксантина в ксантин, а его в мочевую кислоту. Применяют препарат для лечения первичной и вторичной подагры, мочекаменной болезни и ряда злокачественных новообразований при комплексной терапии. Синтез этого лекарственного средства приведен на схеме:

В отличие от получения гипоксантина, для замыкания пиримидинового цикла используют реакцию 5-аминопиразол-4-карбоксамида с формамидом.
Получение препарата гидрохлоротиазид (дихлотиазид, гипотиазид), обладающего диуретическим и гипотензивным эффектом, проходит по схеме 5 + 1. Полный синтез приведен в разделе 2.1.4. Следует отметить, что циклизацию проводят при кипячение 3-хлор-4,6-дисульфаниламиноанилина в 37 % формалине при 100 oС. Аналогично ведут синтез циклопентиазида из 6-хлор-4,6-дисульфаниламиноанилина и циклопентилуксусного альдегида.
Лекарственные препараты фенотиазинового ряда получают циклизацией производных дифениламина (пятиатомный фрагмент цикла) с серой (одноатомный фрагмент).

Синтез хлорпромазина рассматривался в разделе 2.2.1.
Следует лишь отметить, что заместители в бензольном ядре вводятся до получения дифениламина. В синтезе промазина циклизацию ведут при 160 – 180 oС. В качестве катализатора используется иод. В аналогичных условиях получают флуфеназин и другие препараты этого ряда.
Схема синтеза 4 + 2 используется не часто. Наиболее наглядно синтез шестичленных гетероциклических соединений по этой схеме можно проиллюстрировать на примере получения 2,3-диметилхиноксалина из диацетила и о -фенилендиамина:

Эта реакция используется для количественного определения диацетила, который является нежелательной примесью в пиве, вине и шампанском. Окисление диметилхиноксалина до ди-N-оксида, бромирование метильных групп и ацетилирование приводит к получению хиноксидина. Однако препарат хиноксидин синтезируют из фуроксана (четырехатомный фрагмент) и этилметилкетона (двухатомный фрагмент). Полный синтез данного лекарственного средства приведен на схеме:

При кипячении в этилметилкетоне наблюдается раскрытие фуроксанового цикла с образованием реакционноспособного интермедиата, который вступает в реакцию с этилметилкетоном.
Аналогично фуроксану раскрытие пирролидинового цикла изатина дает четырехатомный реакционноспособный интермедиат, реагирующий с кетоном с образованием шестичленного гетероцикла. Так получают 2-метилхи-нолин-4-карбоксамид, промежуточный продукт в синтезе ряда препаратов:

В данном случае наблюдается трехкомпонентная конденсация.
В препарате пирроксан (a-адреноблокатор, применяют для ослабления алкогольной и морфиновой абстиненции) 1,4-диоксановый цикл получают циклизацией пирокатехина с дихлорэтаном. Приводится полная схема синтеза этого лекарственного средства:

При взаимодействии 6-ацетилбензодиоксана с 3-фенилпирролидоном и параформом в присутствии сухого HCl получают целевой продукт.
Введение фрагмента -N-N- с образованием шестичленного гетероцикла рассмотрено в разделе 2.2.3. Взаимодействие малеинового и фталевого ангидрида (четырехатомный фрагмент) с гидразин гидратом (двухатомный фрагмент) приводит к получению пиридазин-1,4-дионового цикла. Реакция используется при получении препаратов сульфапиридазин и дигидралазин (см. раздел 2.2.3).

В синтезе шестичленных гетероциклов широко используется схема синтеза 3 + 3. Примерами реализации этой схемы является получение барбитуратов и пириметамина. Трехатомным компонентом циклизации в данном случае являются производные гуанидина. При синтезе барбитала, барбамила и др. проводят циклизацию алкилэтилмалонового эфира с мочевиной (см. 2.2.1 и 3.2). Гетероциклизация 3 + 3 используется и при получении оротовой кислоты (раздел 3.2.1). Во всех этих случаях, а также при получении производных 6-аминоурацила, в шестом положении пиримидинового цикла имеется заместитель. В отсутствии заместителя в этом положении задача циклизации с получением пиримидинового цикла становится более сложной, т. к. необходимо использовать в качестве одного из компонент малональдегид. В качестве примера можно привести один из методов синтеза 5-фторурацила (раздел 2.3.1). Другим способом является восстановление производных циануксусной кислоты с получением имина, который без выделения из реакционной массы дает производные урацила. Так синтезируют препарат триметоприм, блокирующий стадию восстановления дигидрофолиевой в тетрагидрофолиевую кислоту. Сочетание препарата сульфаметоксазол с триметопримом дает высокий бактериостатический эффект даже на бактерии устойчивые к сульфаниламидным препаратам (см. раздел 2.1.4), т. к. блокируются обе стадии получения метаболита. Синтез триметоприма приведен на схеме:

Технология циклизации подробно рассмотрена на примере получения урацила (раздел 3.2).
По одному из методов получения нитроксалина из 8-гидроксихинолина осуществляют циклизацию о -аминофенола с акролеином, который образуется из глицерина в присутствии серной кислоты:

Акролеин как чистый реагент обычно не применяют из-за его токсических свойств. Альтернативный метод синтеза гидроксихинолина из хинолинсульфокислоты рассмотрен в разделах 2.1.3 и 2.2.3. Процесс прямой гетероциклизации является экологически более приемлемым. Однако использование дешевого коксохимического хинолина, даже с учетом затрат на природоохранные мероприятия, делает альтернативный метод более рентабельным.
Примером необычной окислительной гетероциклизации 3 + 3 является синтез N-оксида феназина (реакция Воля-Ауе). Это реакция нитробензола (трехатомный фрагмент) и анилина (трехатомный фрагмент) идет в присутствии мелко измельченной щелочи. Нитробензол выполняет функцию реагента, окислителя и растворителя:

Модификацией данного метода служит реакция Кегля и Постовского, использовавшаяся (1930 г.) при установлении структуры антибиотика хлорорафина. В реакцию вступают антраниловая кислота и нитробензол в присутствии мелкоизмельченного КОН. В этом случае образуется 1-феназин-карбоновая кислота, а не N-оксид, из которой через хлорангидрид синтезирован амид кислоты. Полувосстановлением амида получен продукт типа хингидрона.
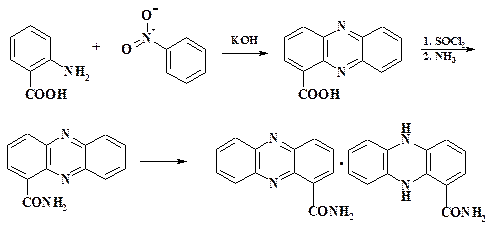
Как известно, хингидрон является молекулярным комплексом бензохинона и гидрохинона. Синтезированное соединение оказалось идентично природному продукту. Антибиотик, к сожалению, имел высокую токсичность.
В синтезе лекарственных соединений широко представлены методы получения шестиатомной цепочки и ее циклизация с образованием гетероцикла. Примерами этого способа является получение производных аминоурацила (теофиллин, теобромин, сульфадиметоксин). Технология их получения приведена в разделе 3.2.
Циклизация производного 2-карбоксидифениламина (шестиатомный скелет гетероцикла) используется в синтезе противомалярийного препарата акрихин. Это производство положило начало одному из крупных предприятий медицинской промышленности РФ комбинату «Акрихин».
Хотя в настоящее время препарат не используется, рассмотрение его синтеза представляет интерес. Конденсацией 2,4-дихлорбензойной кислоты с п -анизидином получают хлордифениламинокарбоновую кислоту, которую превращают в замещенный 9-хлоракридин кипячением в хлорокиси фосфора. При взаимодействии 9-галогенакридина с фенолятом натрия образуется 9-фе-ноксиакридин. Его реакция с 2-аминопентил-5-диэтиламином дает основание акрихина. Следует отметить, что в реакцию нуклеофильного замещения мог бы вступить и сам 9-хлоракридин, но при этом образуется некоторое количество продуктов дизамещения, освободиться от которых довольно трудно. Поэтому предпочитают реакцию с менее активным фениловым эфиром. Кроме того, 9-хлоракридин является лакриматором и его очистка связана с определенными трудностями.

В настоящее время против всех видов малярии применяют хлорохин:

При циклизации b-(2-карбокси-5-хлорфенил)аминопропионовой кислоты под действием уксусного ангидрида одновременно происходит декарбоксилирование. Ацетильную группу удаляют в соляной кислоте. При взаимодействии тетрагидрохинолона с амином о- нитрофенол играет роль окислителя.
Хлорохин, кроме лечения малярии, используют в терапии внекишечного амебиоза, системной красной волчанки, склеродермии и аритмии. Препарат тормозит синтез ДНК и вызывает гибель бесполых эритроцитарных форм всех видов плазмодий, дизентерийной амебы. Связывает свободные радикалы, стабилизирует клеточные и субклеточные мембраны.
В синтезе папаверина и дротаверина замыкание изохинолинового цикла из шестиатомной цепи происходит под действием фосфороксотрихлорида. Подробно синтез этих препаратов рассмотрен в разделе 3.7.
Наряду с постадийным построением скелета цикла используются многокомпонентные реакции циклизации. Классическим примером двухкомпонентной реакции является получение уротропина, который ранее применялся для лечения урологических инфекций:

Примером использования трехкомпонентной циклизации является синтез препарата пемпидин (ганглиоблокатор), блокирующего центральные н-холинорецепторы. Применяют для снятия спазмов периферических сосудов, а также спазмов при язвенной болезни желудка и двенадцатиперстной кишки, при токсикозе беременности. Получение этого лекарственного средства представлено на схеме:

Образование триацетонамина происходит при комнатной температуре при пропускании газообразного аммиака в присутствии безводного хлорида кальция. Это соединение широко используется в органическом синтезе в качестве промежуточного продукта.
Ряд препаратов (имехин, темехин, фенкарол) являются производными хинуклидина. Данный гетероцикл имеет два пиперидиновых кольца с общим атомом азота, содержится в молекуле алкалоида хинин (см. раздел 3.7).
По одному из методов получения производного хинуклидина исходным продуктом является изоникотиновая кислота. Восстановлением кислоты получают пиперидинкарбоновую кислоту. Ее этерификация и алкилирование этиловым эфиром хлоруксусной кислоты приводит к построению цепочки второго шестичленного цикла. В условиях реакции конденсации происходит образование этилового эфира хинуклидинонкарбоновой кислоты. Гидролиз эфира и декарбоксилирование приводит к получению хинуклидона, который используется в синтезе препарата бензоклидин. Это лекарственное средство уменьшает активность корковых нейронов ЦНС, применяется для лечения тревожно-депрессивных состояний, психопатий и неврозов.
Приведена полная схема синтеза препарата бензоклидин из изоникотиновой кислоты:
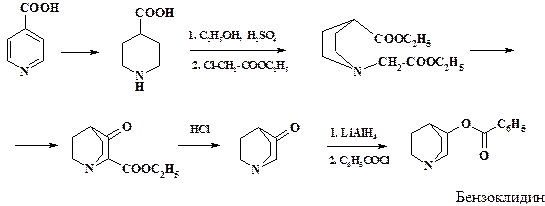
По другому методу синтеза производных хинуклидина, в частности препарата темехин (то же биологическое действие, что и пемпидин, но лечебный эффект несколько выше) в качестве исходного продукта используется триацетонамин:

В этом случае строится шестиатомная цепочка, замыкание второго шестичленного цикла происходит в результате внутримолекулярного алкилирования NH-группы.
Препараты, имеющие семичленный цикл. При получении семичленных гетероциклов используют схему 3 + 4, циклизацию линейного семиатомного скелета, а также перегруппировки с расширением цикла.
В результате перегруппировки Бекмана из оксима циклогексанона образуется капролактам, использующийся в синтезе препарата коразол (раздел 2.2.1).
Диазепины получают реакцией 1,3-дикетонов (трехатомный фрагмент) с этилендиамином (четырехатомный фрагмент). С производными ацетоуксусной кислоты получают диазепиноны.

Наибольшее значение имеет синтез производных бензодиазепина, которые являются снотворными препаратами и транквилизаторами. Их действие обусловлено тем, что они взаимодействуют с бензодиазепиновыми рецепторами, расположенными в аллостерическом центре постсинаптических ГАМК рецепторов. Эти препараты вызывают торможение межнейронной передачи в отделах ЦНС. Одним из наиболее распространенных препаратов является диазепам (апаурин, валиум, диазапекс, сибазон, реланиум). Синтез этого лекарственного средства представлен на схеме:

Исходным продуктом при его получении, как уже отмечалось в разделе 2.2.3, является хлорфенилбензоизоксазол. Алкилированием этого соединения диметилсульфатом в дихлорэтане синтезируют четвертичную соль гетероцикла. Восстановление дает 2 -N- метиламино-5-хлорбензофенон. Ацилирование хлорацетилхлоридом позволяет получить шестиатомный скелет семичленного цикла. Для циклизации используют реакцию с уротропином, при этом атома хлора замещается на аминогруппу и одновременно замыкается цикл. Препарат оксазепам (нозепам, тазепам) имеет тот же механизм действия, что и диазепам. Применяют во время алкогольного опьянения, страхов на фоне алкогольной абстиненции. Однако его не используют для снятия повседневного стресса. Для получения этого лекарственного средства используют то же сырье, но отличие синтеза диазепама и оксазепама заключается в том, что при циклизации вначале образуется восьмичленный цикл, перегруппировка которого дает семичленный. Вначале синтезируют из 2 - амино-5-хлорбензо-фенона оксим, реакция которого с хлорацетилхлоридом и перегруппировка в щелочи приводит к целевому продукту.
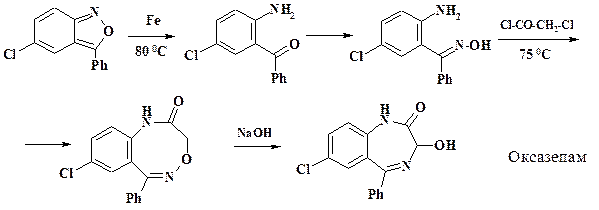
Отличие синтеза препарата феназепам от обычной схемы заключается в получении исходного продукта. Препарат обладает ГАМК-миметическим действием за счет взаимодействия с диазепиновыми рецепторами различных отделов ЦНС. Показаниями к применению являются неврозы, психопатии, ипохондрия, бессонница, эпилепсия и алкогольная абстиненция. Синтез представлен на схеме:


Аналогично феназепаму синтезируют лоразепам, флунитрозепам и флуразепам. Отличия в получении этих препаратов заключаются в использовании различных четырехатомных фрагментов. В молекуле субстанции препарата алпрозолам триазольный цикл надстраивается в бензодиазепине.
Препарат тофизопам относится к 2,3-бензодиазепинам, усиливает ГАМК-миметические процессы в ЦНС и расширяет коронарные сосуды. Применяют его для лечения тех же состояний, что и 1,4-бензодиазепины. Но тофизопам имеет более широкий спектр действия, более эффективен для снятия алкогольной абстиненции и, кроме того, дает хорошие результаты при стенокардии. При получении используют полупродукты синтеза папаверина.
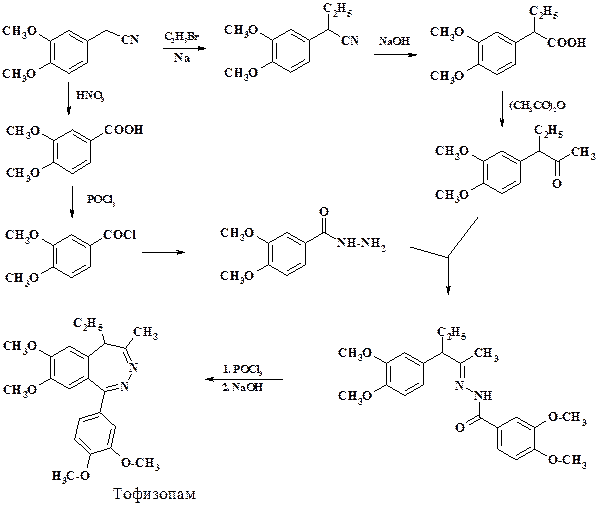
Циклизация гидразона происходит при нагревании в фосфороксотрихлориде.
Препараты, имеющие восьмичленный цикл. Препарат гуанетидин (октадин, изобарин), имеющий в молекуле восьмичленный цикл, является жестким гипотензивным средством за счет вытеснения из гранул симпатических нервных окончаний норадреналина. При постоянном приеме наступает прогрессирующее снижение систолического и диастолического артериального давления. Применяют при тяжелых формах гипертонии.
Синтез этого лекарственного средства представлен на схеме. При плавлении аминоэнантовой кислоты в присутствии щелочи происходит замыкание восьмичленного цикла энантолактама. Восстановление алюмогидридом лития дает гептаметиленимин, который при взаимодействии с формальдегид бисульфитом натрия и ацетонциангидрином образует цианметиленовое производное.

Получение конечного продукта ведут с помощью стандартных методов.
Макроциклические соединения. Антибиотики макролиды – эритромицин и олеандомицин – имеют в молекуле четырнадцатичленный лактоновый цикл. Получение их с помощью синтетических методов нерационально, т. к. они достаточно просто выделяются из культуральной жидкости.
Макроциклические простые эфиры (краун-эфиры), после открытия Педерсона их замечательной способности давать стабильные комплексы с солями щелочных и щелочноземельных металлов, растворимых в органической фазе, нашли широкое применение в органическом синтезе (см. раздел 2.7). В настоящее время получено и используется большое количество краун эфиров, в т. ч. и соединений, содержащих хиральные центры. В качестве примера приведено получение 18-краун-6 эфира. Синтез ведут из триэтиленгликоля и толуолсульфоната триэтиленгликоля (схема 10 + 8) в присутствии третбутилата калия в ДМСО:

Технологические особенности реакций конденсации и гетероциклизации ничем не отличаются от всех других реакций, процесс ведут всегда периодическим способом. Соблюдение техники безопасности и экологических мероприятий имеют те же требования, что и приведенные в разделе 2.2.2.
Дата добавления: 2015-09-04; просмотров: 1104 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Реакции гетероциклизации | | | ОСНОВНЫЕ КОНЦЕПЦИИ КОМБИНАТОРНОЙ ХИМИИ |