
Читайте также:
|
Для медицинской промышленности большое значение имеют реакции синтеза гетероциклических веществ. В результате взаимодействия электрофильного центра цепочки с нуклеофильным фрагментом той же или другой молекулы образуются трех-, четырех-, пяти-, шести-, семи- или макрочленные циклы и отщепляются малые молекулы (вода, сероводород, меркаптаны, спирты, аммиак и т. п.) либо их ионы. Для составления плана синтеза так же, как и при нуклеофильном замещении, чрезвычайно важно предусмотреть все возможные варианты взаимодействия различных фрагментов молекулы. Кроме того, необходимо знать общие закономерности построения связей между элементами C, N, S, O. При разработке плана синтеза весьма эффективен ретросинтетический подход. Уже неоднократно рассматривались реакции гетероциклизации, разбирались примеры, какие группировки могут «генетически» возникать из различных фрагментов (например аминогруппа из нитро-, нитрозо- или азогрупп). Как и в других реакциях необходимо учитывать доступность сырья и экологические последствия проведения процесса в зависимости от масштабов производства. На примерах синтеза пуринового производного теофиллина и противоопухолевого препарата 6-меркаптопурина подробно рассмотрены общие приемы реакций гетероциклизации.
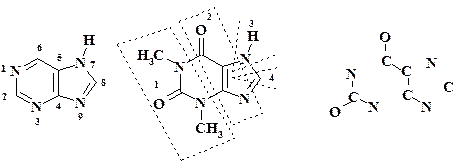
Нумерация атомов в молекуле пуринового гетероцикла является исключением из общих правил: атомы 1 – 6 относятся к пиримидиновому циклу, атомы 4, 5,7 – 9 к имидазольному циклу. Пунктирной линией молекула теофиллина разбита на фрагменты. Для простоты они изображены в виде атомарного скелета. Рассмотрим первый фрагмент – 1- N -метиламино-2-карбонил-3- N -метил-амин, вносящий в цикл три атома. Совершенно очевидно, что этому фрагменту соответствует химический эквивалент 1,3-диметилмочевина. В общем случае при нахождении в молекуле фрагментов N-CO-N можно с уверенностью в план синтеза закладывать использование производных мочевины.
Трехуглеродный остаток (фрагмент O=C-C=C-N) является производным малоновой кислоты. Химический эквивалент – циануксусная кислота – HOOC-CH2-CN.
Прежде чем перейти к фрагментам три и четыре, необходимо сделать одно замечание. Конденсированный цикл имидазопиримидин (пурин) может быть получен вначале из пиримидинового, а имидазольный надстраивается. По второму варианту получают имидазольный цикл с последующей надстройкой пиримидинового.
В случае теофиллина основой построения гетероцикла является пиримидиновый. Из фрагментов один и два уже можно построить пиримидиновый цикл – имеется шесть атомов.
Атомы азота мочевины являются нуклеофильными центрами, а атомы углерода карбоксильной и нитрильной групп, имеющие пониженную электронную плотность, электрофильными центрами:
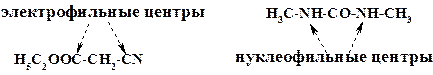
Реакция идет в два этапа (условия подробно рассмотрены в разделе 2.2.2). Диметилмочевина и циануксусная кислота вступают в реакцию ацилирования в присутствии уксусного ангидрида, в результате образуется линейная молекула. На атоме азота мочевины имеется частичный отрицательный заряд, на атоме углерода нитрильной группы – положительный. Однако величин этих зарядов недостаточно для прохождения реакции, поэтому необходимо один из зарядов увеличить.
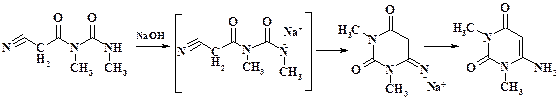
Наиболее простым приемом является увеличение заряда на группе NH, которая имеет кислый характер. При растворении в щелочи на атоме азота возникает целочисленный отрицательный заряд. Его величины уже достаточно для нуклеофильной атаки по атому углерода нитрильной группы. В результате нуклеофильного присоединения к нитрильной группе образуется аминоурацил (иминогруппа переходит в амино, т. к. при этом происходит ароматизация цикла). Итак, первая половина молекулы синтезирована. Следующий этап – создание имидазольного цикла. В положение С-5 пиримидинового цикла необходимо ввести атом азота в виде аминогруппы. Аминогруппа может быть получена из нитро-, нитрозо- или азогруппы.
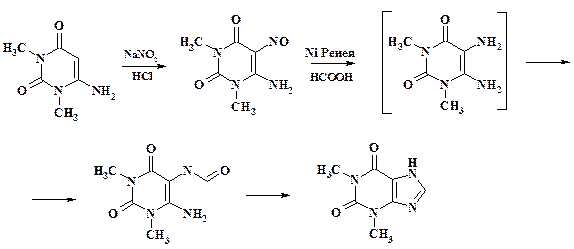
При исследовании этих трех вариантов синтеза оказалось, что оптимальные результаты получены при нитрозировании. Аминогруппа в положении 6 цикла не диазотируется, т. к. низка ее реакционная способность. Следующий этап – восстановление нитрозогруппы (использование различных вариантов восстановления рассмотрено в разделе 2.5). В настоящее время на Курском ХФК внедрено каталитическое восстановление муравьиной кислотой на никеле Ренея что, безусловно, является лучшим методом.
Для завершения создания конечного продукта необходимо ввести одноуглеродный остаток. При восстановлении нитрозопроизводного в муравьиной кислоте реактант уже есть – HCOOH. В процессе восстановления происходит формилирование образующейся аминогруппы, формильное соединение при нагревании циклизуется, давая целевой продукт теофиллин.
При получении противоопухолевого препарата 6-меркаптопурина пиримидиновый цикл надстраивают из имидазольного, но разработка плана синтеза является более сложной задачей. Препарат получают тионированием гипоксантина:
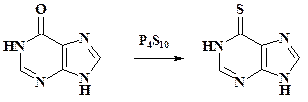
Синтез гипоксантина осуществляют из циануксусного эфира (фрагмент 1).
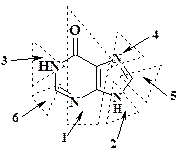
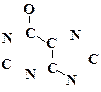
Введение фрагментов 2 и 3 проводят в активированной молекуле этого эфира (см. раздел 2.2.2):
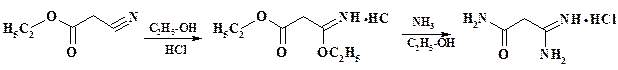
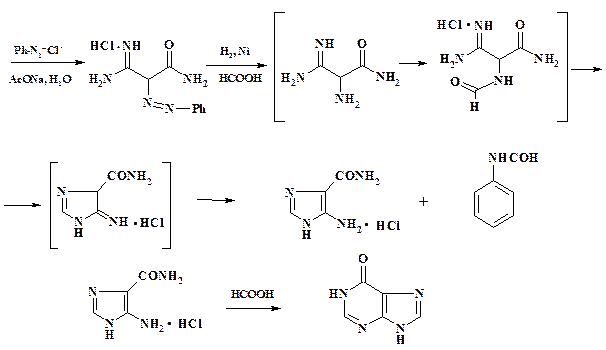
Перед проведением реакции циклизации необходимо в молекулу малонамидоамидина ввести аминогруппу. Лучшие результаты были получены при азосочетании с фенилдиазоний хлоридом (см. раздел 2.4).
Как и при получении теофиллина, восстановление совмещают с циклизацией. Однако, в отличие от теофиллина, при восстановлении азогруппы образуется и второй продукт – форманилид. Если его не удалить, то конечный продукт будет иметь примеси. Для этого упаривают реакционную массу после проведения восстановления и первой циклизации, форманилид экстрагируют бензолом.
Таким образом, в отличие от синтеза теофиллина, вначале с использованием циануксусного эфира в четыре стадии строится линейная молекула 2-аминомалонамидоамидина, являющаяся скелетом конечного соединения. Введением одноуглеродных фрагментов замыкают имидазольный и далее пуриновый циклы.
Промежуточный продукт 5-аминоимидазол-4-карбоксамид (АИКА) может быть выделен и использован при получении препарата дакарбазин.
Для того чтобы разработать план любой конденсации, необходимо обратить внимание на общие правила введения фрагментов и их происхождение (химические эквиваленты), которые приведены далее.
Одноатомные фрагменты. Циклизация с введением одноуглеродного фрагмента с различными функциональными группами:
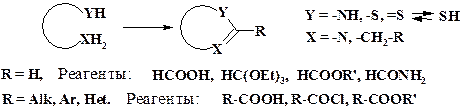
Концевые заместители нециклического скелета молекулы -YH, -XH2 имеют нуклеофильный характер. Для замыкания азольного цикла используют карбоновые кислоты и их производные.
Введение в молекулу гетероцикла карбонильной группы возможно с помощью фосгена, эфиров хлоругольной кислоты или мочевины, цианата натрия, роданистого калия или натрия.
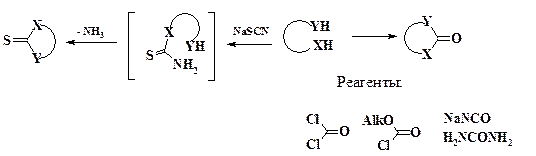
При необходимости введения насыщенного одноуглеродного фрагмента используют альдегиды, полуацетали или ацетали:
H2CO, R-CHO, R-CH(OH)OAlk, R-CH(OAlk)2
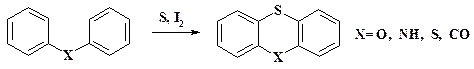
Одним из одноатомных фрагментов скелета гетероцикла является сера. При наличии двух циклов, из которых необходимо получить один конденсированный, проводят реакцию с элементарной серой в присутствии йода:
Атом азота, находящийся в цикле в качестве одноатомного фрагмента, вводят в углеродный скелет молекулы, как правило, до циклизации. Исключением является диазотирование аминогруппы, при котором происходит циклизация:
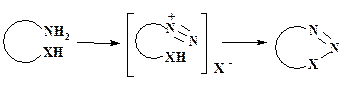
Подробно гетероциклизации этого типа приведены в разделе 2.4.
Двухатомные фрагменты. В качестве химических эквивалентов двухуглеродных синтонов используют эфиры щавелевой кислоты, а также глиоксиловой кислоты и ее производных:
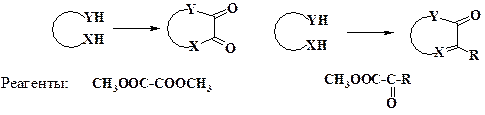
Два атома углерода в скелет гетероцикла можно ввести с помощью эфиров a-галогенкарбоных кислот. При отсутствии в молекуле целевого продукта карбонильных групп применяются a-галогенальдегиды и кетоны:
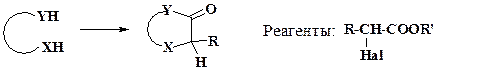
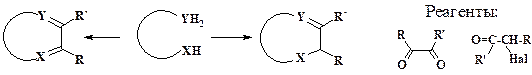
С этой целью используют также глиоксаль и его производные. Интересно отметить, что до недавнего времени имидазолы называли глиоксалинами.
Реагенты, соответствующие двухатомным фрагментам и содержащие гетероатомы, применяют для образования гетероциклических соединений.
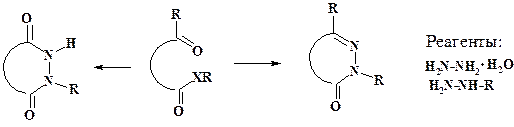
В реакциях гетероциклизации наиболее часто участвуют гидразин гидрат, метил- и фенилгидразин.
Трехатомные фрагменты. В отличие от двухатомных фрагментов, химические эквивалентытрехатомных фрагментов, использующиеся для гетероциклизации, представлены большим количеством соединений. Поэтому будут рассмотрены только наиболее широко применяющиеся в синтезе лекарственных препаратов.
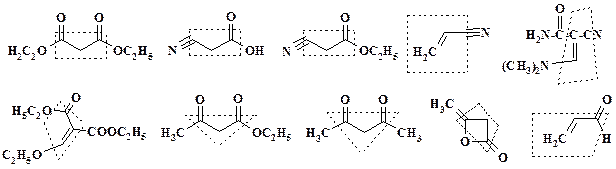
Ранее уже были рассмотрены соединения, которые вносят в цикл три атома углерода: малоновый эфир, циануксусная кислота и ее этиловый эфир, а также этиловый эфир ацетоуксусной кислоты, дикетен и ацетилацетон. Как отмечалось при получении пефлоксацина, для замыкания хинолонового цикла в реакции с дифторанилином используют этоксиметиленмалоновый эфир (см. раздел 2.3), а для аллопуринола a-циано-b-(N,N -диметиламино)-акриламид. К трехатомным фрагментам относятся акрилонитрил и акролеин. Производные циануксусной и цианакриловой кислот, которые являются химическими эквивалентами трехуглеродных фрагментов, описаны в данном разделе (см. раздел 2.7.1).
К соединениям, которые являются предшественниками трехатомных фрагментов цикла и содержат гетероатомы, следует отнести мочевину и ее производные (см. синтез теофиллина), тиомочевину и гуанидин:
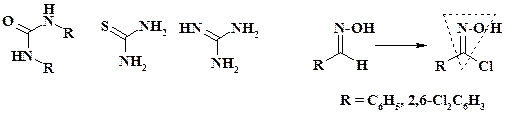
При получении 3-фенил-5-метил-4-изоксазолкарбоновой кислоты (полупродукт в синтезе оксациллина) используют хлорбензальоксим. Это соединение получают хлорированием бензальоксима. Аналогично при синтезе диклоксациллина применяют 2,6-дихлорпроизводное хлорбензальоксима.
Четырехатомные фрагменты. Химические эквиваленты четырехатомных фрагментов, использующиеся в реакциях гетероциклизации, представлены большой номенклатурой и обычно содержат один, два или три гетероатома.
В качестве реактивов, являющихся продуктами основного органического синтеза, можно привести о- фенилендиамин, о- аминофенол и их производные с разнообразными заместителями.
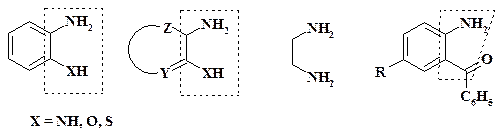
При получении бензодиазепиновых транквилизаторов используются производные о- аминобензофенона, синтез одного из них приведен в разделе 2.2.3.
Помимо указанных ароматических производных с теми же функциями могут быть и гетероциклические соединения. В качестве примера можно привести 5,6-диамино-1,3-диметилурацил в синтезе теофиллина. При синтезе неароматических гетероциклов широко применяют этилендиамин.
Следующим реагентом, который вносит в скелет гетероцикла четырехатомный фрагмент, является тиосемикарбазид:
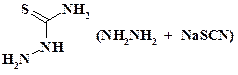
Это соединение может быть получено непосредственно при проведении синтеза из роданистого натрия и гидразина и без выделения использовано на следующей стадии.
При получении АИКА и гипоксантина четырехатомный фрагмент молекулы содержит 2-аминомалонамидоамидин.
Пятиатомные фрагменты. Химические эквиваленты пятиатомных фрагментов также весьма многочисленны. Два из них рассматривались ранее. Это 3-хлор-4,6-дисульфаниламиноанилин и АИКА:
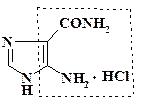
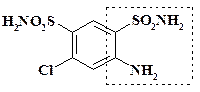
Соединения, имеющие в молекуле амино-, сульфаниламидную или карбоксамидную группы, также при циклизации поставляют в скелет конечного продукта пятиатомный фрагмент. Другие вещества, являющиеся химическими эквивалентами пятиатомных синтонов, не имеют общего характера структуры. Некоторые из них будут представлены при рассмотрении синтеза лекарственных препаратов.
Шестиатомные фрагменты. Если концевой группировкой в шестиатомномфрагменте является карбоксигруппа, то циклизацию проводят под действием таких реагентов, как РOCl3, SOCl2, H2SO4, H3PO4. Кроме фенильных ядер в исходном продукте могут быть и гетероциклы.
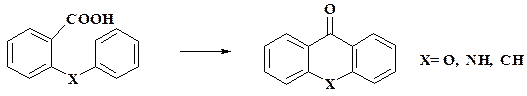
При составлении плана синтеза комбинируют фрагменты с различным содержанием атомов. Например, для диметиламиноурацила в синтезе теофиллина это будет 3 + 3. Конденсированные циклы, как правило, надстраивают последовательно.
Заместители в цикл можно ввести уже в процессе циклизации. Но фармакофорные группы также получают и в результате разнообразных реакций гетероцикла. В зависимости от электроноизбыточности или электронодефицитности цикла отдают предпочтение реакциям электрофильного либо нуклеофильного замещения.
Дата добавления: 2015-09-04; просмотров: 397 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Реакции конденсации | | | Синтез лекарственных препаратов |