
Читайте также:
|
Окисление различных группировок, в первую очередь метильных или алкильных, является одним из основных методов получения карбоновых кислот или их ангидридов. Окисление олефинов при гетерогенном катализе приводит к получению оксиранов – оксидов олефинов. Многотоннажными продуктами являются этиленоксид и пропиленоксид. Гомогенное каталитическое окисление этилена дает ацетальдегид, из которого получают уксусную кислоту и уксусный ангидрид. И, наконец, из кумола синтезируют гидропероксид кумола, разложение которого дает фенол и ацетон. Реакции окисления являются одним из важных методов в органическом синтезе.
Реагенты. Наиболее широко применяется в качестве реагента для окисления кислород воздуха. При этом используют катализаторы: соли и оксиды переходных металлов Со+2, Fe+3, Cu+2, V+5, Mn+2…+7, а также металлы Ag и Cu. Из химических окислителей применяют HNO3, Na2Cr2O7, CrO3, KMnO4, MnO2, NaOCl, Cl2, FeCl3, CuCl2.
Механизм реакции. Окисление является свободно-радикальным процессом, зарождение и рост, а также разветвление цепи представлены на следующей схеме:

На первой стадии окисления кислород отрывает атом водорода от углеводорода, образующийся алкильный радикал реагирует с кислородом, давая пероксидный радикал. Рост цепи обеспечивается его взаимодействием с исходным продуктом. Наиболее легко образуются радикалы из третичных алкилов и далее заместители можно расположить следующий ряд:
СНтрет > СНвтор >СНперв > СНаромат
Разложение гидропероксидных радикалов имеет цепной характер и идет с выделением большого количества тепла, что может привести к взрыву. Образуется большой пул свободных радикалов, и выделение индивидуальных соединений в большинстве случаев практически невозможно. Для увеличения селективности процесса необходимо упорядочить их разложение. Разработку процессов регулированного разложения гидропероксидов осуществил в 1901 г. академик В.Н. Ипатьев (1867-1952; с 1930 г. работал в США). Им было найдено, что ионы переходных металлов при гомогенном катализе играют роль демпфера, поэтапно снижающего скорость реакции.

В качестве катализаторов используют соли металлов Fe, Co, Cu, Mn, Pd.
При гетерогенном катализе также наблюдается регулирование цепной радикальной реакции. Кислород реагирует с поверхностью таких металлов, как серебро, давая пероксид металла, который может региоселективно окислять органические соединения.
Еще одной проблемой проведения процессов окисления в промышленных масштабах является соотношение количества углеводорода и кислорода. Необходимо подбирать концентрации паровоздушной смеси исходных и конечных продуктов так, чтобы они находились вне пределов взрывоопасности.
Несмотря на образование смеси продуктов и высокую взрывоопасность гидропероксидов ряд из них получают в промышленных масштабах. Это относится к синтезу гидропероксида кумола (изопропилбензола), кислотное разложение которого дает фенол и ацетон. Впервые факт получения фенола был отмечен Р.Ю. Удрисом в 1942 г., который был заключенным в одном из сталинских лагерей для ученых, так называемых «шаражек». В промышленных масштабах производство осуществлено в 1949 г. авторским коллективом в составе Р.Ю. Удриса, П.Г. Сергеева и Б.Д. Кружалова.
При окислении кумола идут следующие реакции:

Для того чтобы провести процесс в безопасных рамках, степень конверсии кумола не должна превышать 30 %. Процесс ведут при температуре 100 – 120 oС в колоннах с тарелками либо в каскаде реакторов, снабженных барботерами. Для повышения безопасности в реакционную массу полезно добавлять небольшое количество водного раствора щелочи или соды, которые нейтрализуют муравьиную кислоту, катализирующую разложение гидропероксида. Реакционную массу концентрируют на пленочном испарителе в глубоком вакууме. При этом удаляются легколетучие примеси.
Разложение гидропероксида кумола при добавлении серной кислоты идет с высокой скоростью при большом выделении тепла. Тепловой эффект разложения составляет 2080 кДж на 1 кг. Поэтому реакцию проводят при температуре 50 – 60 oС в растворе ацетона:

Процесс ведут в горизонтальном реакторе с перегородками, температуру поддерживают за счет испарения ацетона, пары которого конденсируют в теплообменнике и значительную часть ацетона возвращают в реактор. Наряду с фенолом и ацетоном образуются ацетофенон и a-метилстирол. Продукты разделяют ректификацией. В настоящее время этот способ вытеснил как экологически более безопасный и экономичный методы синтеза фенола из бензолсульфокислоты и хлорбензола.
Аналогично гидропероксиду кумола получают и гидропероксид этилбензола, из которого синтезируют стирол.
Каталитическое окисление. Окисление проводят в двух вариантах: при гетерогенном и гомогенном катализе. Наиболее широко в качестве гетерогенных катализаторов используют серебро, медь и V2O5.
В медицинской промышленности, в частности при синтезе препарата метронидазол, используют этиленоксид. Поэтому целесообразно рассмотреть синтез этого соединения. Окисление этилена при гетерогенном катализе с участием серебра дает целевой продукт:

В связи с высоким объемом производства процесс является непрерывным. Исходный этилен тщательно очищают от примесей ацетилена и серосодержащих соединений. Катализатором может быть гранулированное серебро или посеребренный оксид алюминия, который получают прокаливанием оксида алюминия с адсорбированным нитратом серебра. Оптимальным соотношением воздух – этилен является 88: 12 объемных процентов. Однако эта смесь взрывоопасна, поэтому приходится снижать концентрацию этилена до 2 – 3 %. Процесс ведут в трубчатом реакторе, заполненном катализатором, внутреннюю поверхность труб тоже необходимо серебрить, т. к. железо служит катализатором полного окисления этилена. В ходе процесса выделяется большое количество тепла (в основном за счет сгорания 50 % этилена), поэтому предусматривают активный отвод тепла. Реакция идет при высокой температуре, в качестве теплоносителя используют ВОТ. Уходящие газы охлаждают и этиленоксид поглощают водой в абсорбере с колпачковыми тарелками. Из водного раствора целевой продукт отгоняют, сушат и ректифицируют. Следует иметь в виду, что этиленоксид является мутагеном и низкокипящей жидкостью (Ткип 10,8 oС), пары в широких пределах дают с воздухом взрывоопасные смеси (от 3 до 80 объемных процентов). Это свойство используют в производстве объемных взрывов (вакуумная бомба). Сам этиленоксид может детонировать, поэтому перевозку его осуществляют в баллонах автомобильным транспортом. Аналогично можно получить и оксид пропилена. Также возможно жидкофазное окисление пропилена. Кроме того, пропиленоксид может быть синтезирован взаимодействием пропилена с надуксусной кислотой, гидропероксидами кумола или этилбензола (последний называют Халкон-процессом):

Совмещенное производство стирола из этилбензола и пропиленоксида экономически выгодно. Катализатором переноса кислорода из гидропероксида к пропилену служит нафтенат молибдена. Процесс эпоксидирования ведут при 100 – 110 oС и давлении 2,5 – 3 МПа в каскаде из нескольких реакторов (в целях безопасности), охлаждаемых водой. Продукты реакции разделяют последовательной ректификацией, пропилен возвращают на эпоксидирование.
Окисление этилена в воде при гомогенном катализе приводит к получению ацетальдегида:

Катализаторный раствор: H2O (60 %); FeCl3 (1 – 5 %); PdCl2 (0.3 – 0.5 %); Cu(OCOCH3)2 (2 – 3 %); CuCl2×2 H2O (12 –33 %).
Постадийно процесс может быть представлен на следующей схеме:

Таким образом, соли палладия и меди выполняют роль переносчиков кислорода. Вначале образуется комплекс этилена с хлоридом палладия, разложение которого водой дает ацетальдегид.
В реактор, содержащий катализаторный раствор, непрерывно подают этилен и технический кислород. Поддерживают температуру за счет испарения воды и ацетальдегида. В реактор подают также непрерывно воду в том количестве, которое удаляется из реактора. Уходящие пары охлаждают, поглощают в скруббере, орошаемом водой, непрореагировавший этилен вновь направляют в реактор. Водный раствор ацетальдегида направляют на ректификацию. Лучшие результаты получены при двухстадийном проведении процесса. На первой стадии происходит образование ацетальдегида, а на второй регенерация катализатора. Реакционный раствор обладает высокой коррозионной активностью, поэтому реактор изготовляют из титана. Ацетальдегид – легкокипящая жидкость (Ткип 21 oС), с резким запахом, пределы взрываемости паровоздушных смесей 3,5 – 57 объемных процентов.
При проведении реакции с гранулированным катализатором, содержащим хлориды меди и палладия, и введении в реакционную смесь паров уксусной кислоты образуется винилацетат:

Основное количество ацетальдегида идет на получение уксусной кислоты и уксусного ангидрида. Промышленное значение имеет их одновременное получение:

В качестве катализатора используют смесь ацетатов кобальта и меди, этилацетат вводят в реакцию для удаления воды в виде азеотропной смеси. Необходимо строго поддерживать температуру в рамках регламента из-за возможности накопления надуксусной кислоты и полного окисления ацетальдегида. Непрореагировавший ацетальдегид и этилацетат после отделения воды вновь направляют в реактор. Целевые продукты разделяют ректификацией. Уксусная кислота может быть получена также и при окислении бутановой фракции газа, но качество продукта существенно ниже. Пищевую уксусную кислоту получают брожением (яблочный уксус).
С помощью гомогенного каталитического окисления м- ксилола получают м- толуиловую кислоту – промежуточный продукт в синтезе репеллента ДЭТА (диэтиламид толуиловой кислоты):
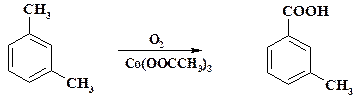
Процесс ведут в емкостном аппарате, снабженном барботером, в избытке ксилола, который является растворителем. При достижении концентрации кислоты около 40 % ее отфильтровывают, а раствор вновь передают на проведение окисления. Процесс может быть осуществлен и в непрерывном варианте в колонне.
Большое значение как в основном органическом синтезе, так и в ХФП, имеет фталевый ангидрид, который получают окислением коксохимического нафталина или о- ксилола:

Реакция идет в присутствии катализатора (оксид ванадия) при температуре 350 – 400 oС. До 10 % окисляемого субстрата сгорает полностью, в качестве побочного продукта образуется около 5 % малеинового ангидрида.
Процесс проводят в трубчатом реакторе, в трубном пространстве катализатор, в межтрубном пространстве расплав нитрита, нитрата натрия и нитрата калия. В связи с высоким тепловым эффектом (для окисления нафталина 432 ккал/моль) и высокой температурой использование других теплоносителей нецелесообразно. При окислении ксилола, пределы взрывоопасных концентраций которого существенно больше, чем для нафталина, содержание его в паровоздушной смеси составляет около 1 объемного процента. Уходящие из конвертора газы, содержащие около 1 % фталевого ангидрида, охлаждают. Очистку фталевого ангидрида осуществляют сублимацией.
Окисление производных нафталина, имеющих в одном из циклов электроноакцепторные заместители, приводит к окислению цикла, не содержащего этот заместитель. Наличие электронодонорной группы облегчает окисление цикла, в котором она находится.
Так при окислении 1-аминонафталина основным продуктом является фталевый ангидрид, а из 1-нитронафталина получают 3-нитрофталевый ангидрид. Последнее соединение применяют в синтезе люминофора – люминола (5-амино-2,3-дигидрофталазин-1,4-дион), натриевая соль которого обладает иммуномодулирующими свойствами и противовоспалительным эффектом (препарат тамерит).

Однако из-за малого объема производства дешевле получать 3-нитро-фталевую кислоту нитрованием фталевого ангидрида, хотя при этом образуется также и 4-нитрофталевая кислота.
Аналогично получению фталевого ангидрида из о- ксилола при окислении п- ксилола получают терефталевую кислоту, которая используется в производстве лавсана.
Окисление химическими реагентами. Каталитическое окисление группировок, как правило, используется при большой мощности производства непрерывным методом. При малотоннажных производствах применяют методы окисления химическими реагентами. Так при получении анестезина, новокаина, дикаина и других препаратов, обладающих местноанестезирующим действием, промежуточным продуктом является п -нитробензойная кислота, которую получают окислением п -нитротолуола:
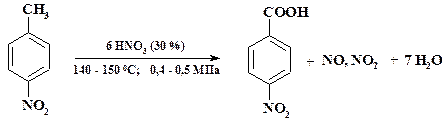
Синтез проводят периодическим способом, т. к. тоннаж целевого продукта невысок. В эмалированном аппарате суспендируют в 30 % азотной кислоте при перемешивании п- нитротолуол и нагревают до 130 oС, поддерживая температуру в ходе процесса не выше 150 oС. После окончания реакции полученную кислоту отфильтровывают. Оксиды азота стравливают и поглощают щелочью.
Аналогично получают изоникотиновую кислоту:

Пиколиновую фракцию кипятят в растворе формалина, острым паром отгоняют b-пиколин, 2,6-лутидин и формалин. К оставшемуся раствору g-мети-лольных производных добавляют 60 % азотную кислоту и выдерживают при 100 oС и перемешивании несколько часов. Полученный раствор осветляют углем, фильтруют и нейтрализуют содой. Процесс ведут в эмалированном аппарате, оксиды азота поглощают щелочью.
В синтезе психотропных препаратов фенотиазинового ряда, в частности хлорпромазина (аминазина), используют 2,4-дихлорбензойную кислоту, которую получают из соответствующего производного толуола. Процесс проводят в условиях, аналогичных синтезу п- нитробензойной кислоты.

Окисление азотной кислотой нитрозогруппы в нитрогруппу применяют при получении препарата нитроксалин (раздел 2.3.2). Процесс ведут в эмалированном аппарате.
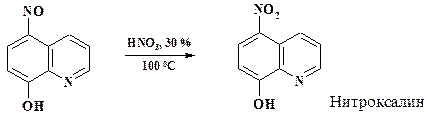
При синтезе никотиновой кислоты (витамина РР) окисление азотной кислотой не приводит к желаемому результату. Приходится использовать более сильный окислитель – перманганат калия:

Процесс окисления ведут в эмалированном аппарате. Перманганат добавляют порциями с помощью шнекового питателя в раствор b-пиколина в щелочи. Выпавший осадок диоксида марганца отфильтровывают, при подкислении фильтрата выделяется никотиновая кислота.
Окисление бензольного кольца в бензимидазоле используется при синтезе препарата этимизол. Это лекарственное средство стимулирует дыхательный и двигательный центры продолговатого мозга (аналептик), обладает противовоспалительным, противоаллергическим действием, снимает чувство тревоги. Этимизол индуцирует выработку адренокортикотропного гормона (АКТГ), ингибирует фосфодиэстеразу, способствует накоплению внутриклеточного ц-АМФ, усиливает гликогенолиз, активирует метаболитические процессы в ЦНС. Полный синтез приведен на схеме:

Окисление бензимидазола проводят хромовым ангидридом или бихроматом натрия в 70 % серной кислоте при 85 – 90 oС. Как и в случае нитронафталина, окислению подвергается цикл, несодержащий электроноакцепторный заместитель. В условиях проведения процесса имидазольный цикл протонирован, а положительный заряд делокализован между двумя равноценными атомами азота, окисляется бензольный цикл. После окончания процесса реакционную массу выливают на охлажденную воду, выпавший осадок 4,5-имидазолдикарбоновой кислоты отфильтровывают. Следует отметить, что окисление солями хрома является экологически напряженным процессом, т. к. ионы шестивалентного хрома высокотоксичны, попадание их в сточные воды недопустимо и строго регламентируется. Поэтому фильтрат после отделения имидазолдикарбоновой кислоты подщелачивают, вводят слабый восстановитель, оксид трехвалентного хрома отфильтровывают.
В разделе 2.1.6. при описании получения хлораля из этилового спирта отмечалось использование хлора в качестве окислителя. В синтезе противовирусного препарата оксолин хлорирующие агенты также используются в качестве окислителей. Это лекарственное средство в виде мази применяют для лечения гриппа, вирусного ринита, герпеса и кератита.
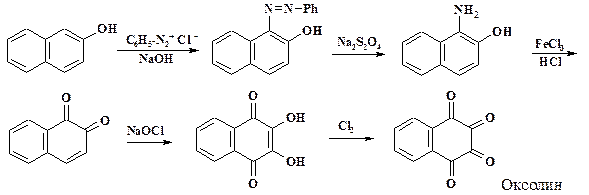
Окисление хлорным железом 1-амино-2-нафтола, который получают восстановлением азосоединения, синтезированного из 2-нафтола и фенилдиазоний хлорида, дает 1,2-нафтохинон. Отфильтрованную влажную пасту нафтохинона суспендируют в воде и медленно прибавляют раствор гипохлорита натрия. Полученный изонафтазарин переосаждают из щелочи соляной кислотой с добавлением для очистки акивированного угля. Дальнейшее окисление до 1,2,3,4-тетрагидро-1,2,3,4-тетраоксонафталина проводят хлором при температуре 40 oС. Использование других окислителей приводит к получению примеси фталевой кислоты.
При действии гипохлорита натрия и хлора хлорирования в цикл не наблюдается, т. к. в нафталиновом ядре уже имеются электроноакцепторные группы и отсутствует катализатор хлорирования.
Дата добавления: 2015-09-04; просмотров: 687 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Восстановление нитрогрупп | | | Дегидрирование |