
|
Читайте также: |
Одной из важнейших реакций солей диазония является азосочетание, которое используется, как отмечалось в начале раздела, в синтезе препаратов салазодиметоксин, салазопиридазин, мескамин, триазотрин и витамина В2. В настоящее время по-прежнему выпускаются тысячи тонн азокрасителей. Обычно соль диазония называют диазосоставляющей, а субстрат азосоставляющей. Азосочетание является типичной реакцией электрофильного замещения.
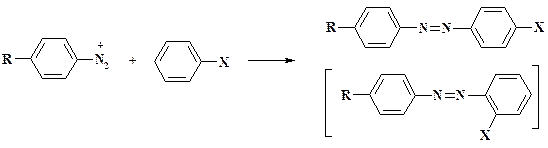
Заместитель Х должен обладать сильным электронодонорным характером – OH, NH2, NR1R2. Если Х = OCH3, CH3, то реакция идет только с наиболее реакционноспособными диазосоставляющими, такими, как пикрилдиазоний сульфат (три нитрогруппы в молекуле), или гетероциклическими солями диазония, у которых гетероцикл обладает сильным электроноакцепторным характером. При Х = Н, COOH и тем более NO2 реакция не идет. Естественно, азогруппа вступает в о -, п -положение по отношению к электронодонорному заместителю Х. Реакцию с фенолами ведут в слабощелочной среде, с аминами – в слабокислой. Это объясняется тем, что величина ЕВЗМО производных анилина выше, чем энергия производных фенола с теми же заместителями, однако существенно ниже величины ЕВЗМО фенолят иона.
ЕВЗМО (ArO-) >> ЕВЗМО (ArNH2) > ЕВЗМО (Ar-OH)
При наличии в одной молекуле азосоставляющей и гидрокси- и аминогруппы региоселективность обеспечивают за счет проведения реакции при различных значениях рН. Сочетание в о-, п- положение к фенольной группе проводят в слабощелочной среде, а азосочетание в о-, п- положение к аминогруппе – в слабокислой среде. Если рассмотреть величину коэффициента АОВЗМО на атомах углерода в молекуле, содержащей как амино-, так и гидроксигруппу, то в неионизированной молекуле величина коэффициента АОВЗМО в о- или п- положениях к аминогруппе выше, чем на атомах углерода в о- или п- положениях к гидроксигруппе. Ситуация меняется на обратную при превращении фенола в фенолят ион.
Наряду с ароматическими азосоставляющими, реакция сочетания идет и с СН-кислотами. Некоторые диазосоединения азолов реагируют аналогично арильным солям диазония, их соли диазония существенно более реакционноспособны.
Лимитирующей стадией процесса азосочетания в зависимости от условий его проведения является как образование s -аддукта, так и отрыв протона. В общем случае скорость реакции может быть описана следующим уравнением
V = k1k2 [ArN2+][ArX][B]/ k-1 + k2 [B]
где k1 – константа скорости образования s-аддукта, k2 – константа скорости отрыва протона, B – основание, k - 1 – константа скорости обратной реакции.
Нами для гетероциклических и ароматических азосоединений было показано, что в уксусной кислоте в присутствии толуолсульфокислоты реакция азосочетания является обратимой.
Технология реакций азосочетания. В первую очередь необходимо учитывать, что к моменту окончания процесса диазотирования аппаратура для проведения азосочетания должна быть полностью подготовлена. Реакцию проводят при температуре 10 – 15 oС в емкостных аппаратах, снабженных рубашкой для охлаждения, рамной или якорной мешалкой.
При сочетании с фенолами при рН 7 – 10 к раствору азосоставляющей приливают раствор соли диазония (прямой порядок смешения). Температурный режим регулируют скоростью прибавления реагентов. При сочетании с аминами вначале готовят раствор или тонкую суспензию амина и постепенно добавляют к раствору соли диазония. Значение рН поддерживают в пределах 3 – 6 за счет одновременного прибавления раствора соды (обратный порядок смешения реагентов). Для предотвращения образования триазена из незамещенного или монозамещенного амина реакцию проводят при возможно более низких значениях рН или вводят в аминогруппу защитные группировки. При целенаправленном получении триазена реакцию ведут в органическом растворителе, например, в хлористом метилене или метаноле. При получении противоопухолевого препарата дакарбазина суспензию диазоимидазолкарбоксамида в метаноле добавляют к метанольному раствору диметиламина при низкой температуре. Как диазосоединение, так и дакарбазин высокопожаро- и взрывоопасны. По чувствительности к удару, удару со смещением они близки штатным взрывчатым веществам, а по чувствительности к искре к паровоздушным смесям к ЛВЖ. Поэтому вся аппаратура должна быть заземлена и выполнена в пожаробезопасном исполнении.
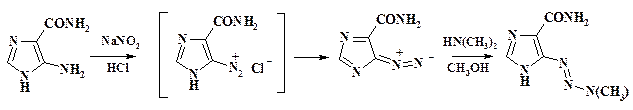
В митохондриях печени происходит гидроксилирование одной из метильных групп дакарбазина, отщепление гидрокисметильной группы, распад монотриазена до диазометана. Диазометан алкилирует гуанин ДНК, что приводит к необратимым изменениям раковой клетки.
В медицинской промышленности реакция азосочетания используется в производстве салазопиридазина и салазодиметоксина. Сульфапиридазин или сульфадиметоксин растворяют в щелочи, добавляют нитрит натрия и полученный раствор медленно приливают в охлажденную до 0 oС соляную кислоту. К выпавшей в осадок соли диазония при температуре 0 – 5 oС в один прием приливают раствор салициловой кислоты в щелочи.
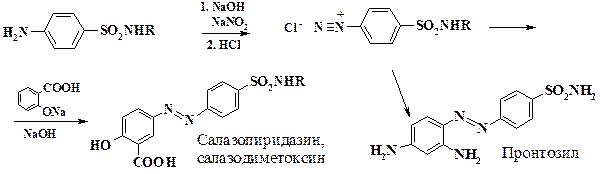
В организме азосоединения восстанавливаются до исходного сульфаниламида и аминосалициловой кислоты, также обладающей биологической активностью. Следует отметить, что первым сульфаниламидом был пронтозил (красный стрептоцид) – краситель хлопчатобумажных тканей, который получали сочетанием 1,3-фенилендиамина с п- диазобензолсульфаниламидом (R = H). Окрашенные им ткани обладали бактерицидным действием и заживляли гнойные раны. Вначале красный стрептоцид использовали в неизмененном виде. Но образующийся в организме 1,2,4-триаминобензол является токсичным соединением. Позднее было выяснено, что п- аминосульфаниламид обладает более высокой активностью, и белый стрептоцид стал применяться в практике. Это положило начало эры сульфаниламидных препаратов.
Так же, как и в организме, химически азогруппа может быть восстановлена, давая два ароматических амина. Этот синтетический прием используют при получении витамина В2 – рибофлавина. Рибитиланилин сочетают с фенилдиазоний хлоридом. Полученное азосоединение конденсируют с барбитуровой кислотой. Следует отметить, что реакцию азосочетания ведут при рН 3 – 4 для того, чтобы предотвратить N-азосочетание.
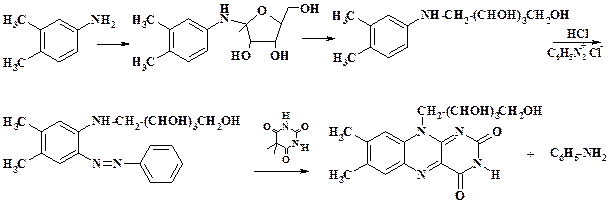
При конденсации азосоединения с барбитуровой кислотой последняя выполняет роль восстановителя азогруппы (подробно методы синтеза рибофлавина рассмотрены в разделе 3.5).
Реакцию азосочетания с СН-кислотами используют при получении препарата мескамин (радиопротектор – профилактическое средство, предупреждающее возникновение лучевой болезни), а также при синтезе серотонина. Синтез мескамина (5-метокситриптамина) представлен на схеме:
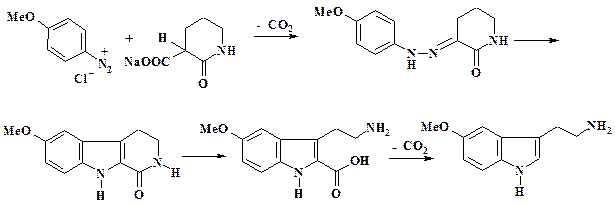
В обычных условиях диазотируют п- анизидин и раствор диазосоединения приливают к щелочному раствору 3-карбоксипиперидона-2 при температуре от 0 до минус 2 oС. При азосочетании одновременно происходит декарбоксилирование. Полученный гидразон при действии кислотного катализатора по реакции Фишера превращается в 5-метокситетрагидро-β-карболинон. Под действием щелочи происходит раскрытие пиперидонового цикла. Для получения мескамина проводят декарбоксилирование последнего продукта кипячением в соляной кислоте в атмосфере азота.
В синтезе 5-аминоимидазол-4-карбоксамида, который является биогенным предшественником пуринов, а также в синтезе противоопухолевых препаратов дакарбазина и 6-меркаптопурина (полная схема синтеза этих соединений приведена в разделе 2.7) для введения аминогруппы используют сочетание фенилдиазоний хлорида с малонамидинамидом:
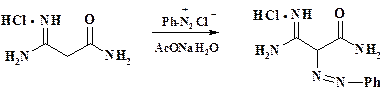
В молекуле исходного соединения имеются NH- группы и СН2-группа, по которым может пойти сочетание. В условиях реакции гидрохлорид не переходит в основание и этот центр оказывается блокированнным, поэтому идет только С- сочетание. Осадок красителя отфильтровывают.
Препарат триазотрин является антагонистом метаболитов пуринового обмена, обладает широким спектром противовирусной активности. Его синтез включает азосочетание гетероциклической соли диазония с нитромалоновым эфиром:
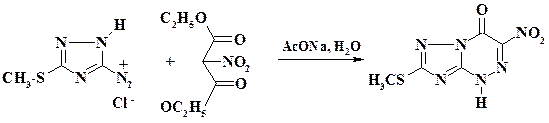
В процессе реакции при сочетании происходит гидролиз одной из эфирных групп, декарбоксилирование и циклизация.
Дата добавления: 2015-09-04; просмотров: 301 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Строение солей диазония, реакционная способность | | | Восстановление диазосоединений |