
Читайте также:
|
Как видно из формулы соли диазония, положительный заряд находится на атоме азота, связанного с ароматическим ядром. Но все реакции с нуклеофилами идут по крайнему атому азота, формально не имеющему положительного заряда. Квантово-химические расчеты (метод CNDO) показали, что на этом азоте положительный заряд есть, хотя и меньший, чем на первом:

R= CH3 q2 = + 0,207; q1 = + 0,284 EНСМО = - 3,9 эВ ЕВЗМО= - 19,4 эВ
Н q2 = + 0,209; q1 = + 0,288 EНСМО = - 4,9 эВ ЕВЗМО= - 19,6 эВ
NO2 q2 = + 0,235; q1 = + 0,298 EНСМО = - 7,2 эВ ЕВЗМО= - 19,9 эВ
Более точные данные, полученные с помощью неэмпирического расчета STO-3G, показывают наличие положительного заряда на втором атоме азота (+ 0,279), который больше чем на первом (+0,083):

При попытке корреляции величины заряда на терминальном атоме азота с реакционной способностью в реакции азосочетания оказалось, что корреляция полностью отсутствует. В работах И.Л. Багала было показано, что реакционная способность определяется величиной энергии низшей свободной орбитали молекулы. Соли диазония являются самыми "мягкими" реагентами (в терминах ЖМКО), и реакции идут при орбитальном контроле. Введение электроноакцепторных заместителей уменьшает ЕНСМО и увеличивает реакционную способность, электронодонорные заместители действуют наоборот.
Следует отметить, что единственной реакционноспособной формой является соль диазония. В то же время при увеличении рН происходят прототропные превращения, уменьшающие концентрацию соли диазония.
При повышении рН до 3 – 5 к молекуле арилдиазоний хлорида присоединяется гидроксид анион и образуется Z-диазогидроксид (син-, цис -диазогидроксид), который находится в равновесии с солью диазония и Z-диазотатом. При этом в растворе свободный диазогидроксид содержится в пределах от 0,5 до 20 %. При дальнейшем повышении рН равновесие смещается в сторону Z-диазотата и при рН 11 – 14 это соединение становится основным. Медленно Z-диазотат переходит в более устойчивый Е-диазотат, обратный переход возможен в фотохимических условиях. Одной из устойчивых форм диазосоединений являются Е-диазотаты натрия. При подкислении они превращаются в нитрозамины, а не в диазогидроксиды. Нитрозамины при подкислении дают соль диазония и частично разлагаются до амина.
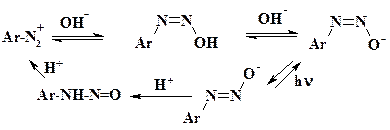
Прототропные переходы необходимо учитывать при проведении реакций солей диазония.
Дата добавления: 2015-09-04; просмотров: 107 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Диазотирование ароматических аминов | | | Реакция азосочетания |