
Читайте также:
|
В синтезе лекарственных препаратов используют бензотрифторид, фторбензол и производные полифторбензола. Из фторбензола синтезируют большую группу нейролептиков группы бутирофенона – галоперидол, трифлуперидол, пенфлюридол, флуспирилен и другие:

На примере препарата трифлуперидол рассмотрен полный синтез на основе фторбензола и бензотрифторида.

Первая стадия получения препаратов этой группы является общей и для препарата галоперидол (рассмотрен в разделе 2.1.5).
Бутирофеноны обладают анальгезирующим, противосудорожным, антигистаминным, антипсихотическим, нейролептическим и седативным действием. Блокируют центральные альфа-норадренергические, дофаминэргические рецепторы. Они эффективны для купирования различного рода возбуждения, острого бреда и маниакальных состояний. Применяют для лечения шизофренических психозов, параноидальных бредовых состояний, олигофренических и алкогольных психозов. Оказывают противосудорожное и противорвотное действие, усиливают действие снотворных препаратов и анальгетиков. Препараты отличаются по своей активности и побочному действию.
Бензотрифторид используется в качестве исходного сырья в синтезе препарата трифтазин (стеллазин, трифлюперазин). Это производное фенотиазина оказывает более сильное нейролептическое, седативное и противорвотное действие, чем хлорпромазин. Синтез препарата приведен на следующей схеме:

В качестве исходного сырья могут использоваться м- бромбензотрифторид и анилин. Реакцию проводят в присутствии порошка меди, йодистого калия и поташа. Формулы других препаратов этого ряда приведены на схеме:
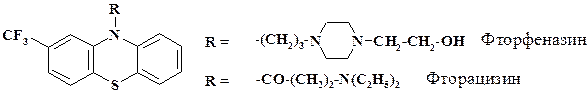
Аналогично трифтазину из бензотрифторида синтезируют флуфеназин (фторфеназин), обладающий высокой нейролептической и противорвотной активностью. Также из бензотрифторида получают сильный антидепрессант фторацизин.
Большая группа синтетических антибактериальных препаратов являются производными 4-хинолон-3-карбоновой кислоты. Первыми лекарственными средствами, вошедшими в медицинскую практику, были налидиксовая кислота (невиграмон, неграм – от слова грамнегативный, 7-метил-4-оксо-1-этил-1,4-дигидро-1,8-нафтиридин-3-карбоновая кислота) и оксолиниевая кислота (грамурин). Недостатком этих препаратов является то, что они быстро выводятся из организма за счет окисления бензольного цикла оксидазами. Введение в положение 6 хинолонового цикла атома фтора приводит к предотвращению расщепления соединений под действием оксидаз. В данном случае атом фтора выполняет роль блокирующей группировки.
В условиях острой конкуренции ведущие фармацевтические фирмы создали и ввели в медицинскую практику большую группу синтетических антибактериальных средств третьего поколения, являющихся производными 6-фтор-4-оксо-1,4-дигидро-3-хинолинкарбоновой кислоты. Сумма продаж этих препаратов в мире превышает 1 млрд долларов.
Установлен механизм действия фторхинолонов. Они проникают в бактериальную клетку и ингибируют особую ДНК-топоизомеразу, которую называют ДНК-гиразой. Данный фермент вызывает суперспирализацию ДНК за участком, в котором открыты (свободны для транскрипции) 10 нуклеиновых оснований. Без суперспирализации в молекуле ДНК возникли бы существенные напряжения, которые потребовали бы увеличения числа оснований, приходящихся на один виток, до 11. Фермент найден только в клетках прокариот. В клетках эукариот имеются ферменты, которые могут разрезать одну или обе нити ДНК (ДНК-топоизомеразы I или II) и тем самым снимать в спирали напряжение при генной экспрессии. Однако активные центры этих ферментов существенно отличаются от такового в ДНК-гиразе. Ингибирование ДНК-гиразы приводит к блокированию синтеза РНК на матрице ДНК, что ведет к гибели клетки. Фторхинолоны действуют только на бактериальные клетки и не мешают функционированию ДНК в клетках хозяина. Поэтому, в отличие от высокоэффективных антибиотиков аминогликозидного ряда, токсичность препаратов низка – «волшебная пуля Эрлиха». Формулы основных препаратов приведены на схеме:
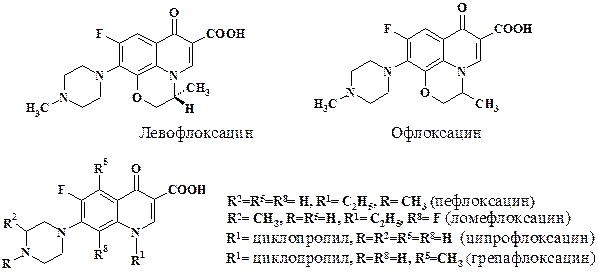
Следует отметить, что ципрофлоксацин производится 10 фармацевтическими фирмами и имеет 10 синонимов.
Основными показаниями к применению препаратов норфлоксацин, левофлоксацин, грепафлоксацин, ломефлоксацин, офлоксацин, пефлоксацин, спарфлоксацин, ципрофлоксацин, циклопентолат, циноксацин, эноксацин, моксифлоксацин являются инфекции мочевых путей, осложненные инфекции дыхательных путей (при грамотрицательной флоре), инфекции, вызванные сальмонеллами и шигеллами, остеомиелит, простатит, инфекции, вызванные Pseudomonas.
В синтезе фторхинолонового цикла могут быть выделены две основные схемы. В первой из них исходят из производных фторанилина, а во второй из производных фторбензойной кислоты.
В качестве примера синтеза по первому направлению приводится общая схема синтеза из 3,4-дифторанилина, разработанная под руководством академика РАН О.Н. Чупахина на кафедре органической химии УГТУ-УПИ.

Исходным продуктом является о -дифторбензол, который получают по методу, разработанному О.М. Нефедовым. Синтез дифторбензола исходя из 2,6-дихлорфторбензола существенно дороже, чем из дифторкарбена и бутадиена. Нитрование этого соединения и восстановление нитрогруппы рассмотрено в разделе 2.5. Конкретные условия конденсации, циклизации, гидролиза сложноэфирной группы, алкилирования цикла и нуклеофильного замещения атома фтора рассмотрены в соответствующих разделах. На схеме указаны только температура реакций и растворители.
По второму методу, который имеет более широкие синтетические возможности, исходят из производных полифтор(хлор)бензойных кислот. Этот способ рассмотрен на примере получения одного из широко использующихся препаратов – ципрофлоксацина. Исходным продуктом в синтезе данного препарата является 3-фтор-4,6-дихлорбензойная кислота. Однако это соединение не производят в крупном масштабе. Для ее получения проводят нитрование 2,4-дихлорбензойной кислоты (промежуточный продукт в синтезе хлорпромазина, раздел 2.7.5), восстановление нитросоединения дитионитом натрия, диазотирование амина и замену диазониевой группы на фтор.

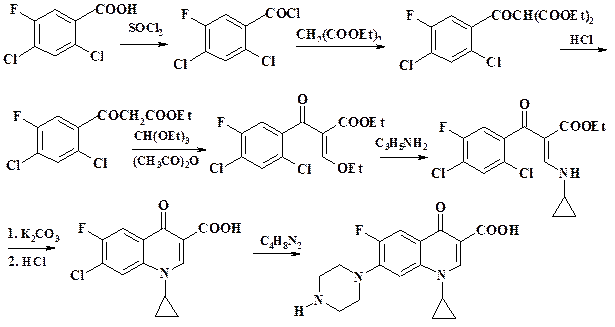
Конкретные условия, в которых протекают реакции, рассмотрены в обзоре (см. [8] литература к данному разделу). Аппаратура для проведения процессов обычная емкостная. Однако следует отметить, что при замещении фтора не следует использовать эмалированные реакторы, т. к. выделяется фтороводород.
В настоящее время активно ведется работа по поиску новых препаратов в ряду фторпроизводных. По мере промышленного освоения синтеза полифторарильных производных расширяется и ассортимент производимых препаратов.
2.4. ДИАЗОТИРОВАНИЕ И ДИАЗОРЕАКЦИИ
Использование реакций диазосоединений в медицинской промышленности и органическом синтезе, диазотирование ароматических, гетероциклических и алифатических аминов, строение солей диазония и диазосоединений, условия проведения реакции, прототропные превращения, реакционная способность. Реакции солей диазония: разложение, C- и N-азосочетание, дедиазотирование, замена диазониевой группы на Cl, Br, I, CN,, N3, SH и др. Технология проведения реакций, экология.
Хорошо известны широкие возможности использования ароматических солей диазония в органическом синтезе – реакции с выделением и без выделения азота, которые представлены на схеме:
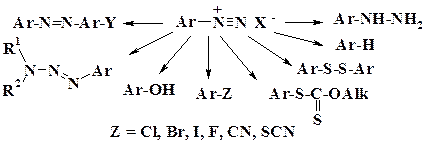
В промышленном органическом синтезе наиболее многотоннажными продуктами являются азокрасители, которые получают реакцией азосочетания. Некоторые лекарственные препараты и промежуточные продукты, в синтезе которых используются реакции диазосоединений, представлены на схеме:
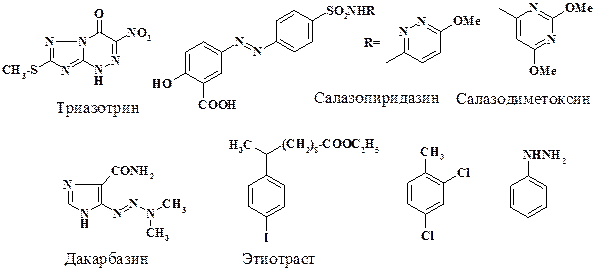
Реакции солей диазония с выделением азота используют при региоселективном получении ароматических галогенопроизводных (в частности, в синтезе 2,4-дихлоротолуола, промежуточного продукта при получении хлорпромазина), а также для введения атома йода в ароматическое ядро при отсутствии электронодонорных заместителей (синтез рентгеноконтрастных средств, например, препарата этиотраст). Реакцию азосочетания используют при получении сульфаниламидных препаратов, таких как салазопиридазин и салазодиметоксин (подробно о действии в разделе 2.1.3), а также в синтезе рибофлавина. Эта же реакция с СН-кислотой и последующая циклизация приводит к получению активного противовирусного препарата триазотрин (действие препарата рассмотрено в данном разделе). Реакцией азоаминосочетания из гетероциклического диазосоединения синтезируют противораковый препарат дакарбазин. Наиболее крупнотоннажным производством в медицинской промышленности является восстановление фенилдиазоний хлорида до фенилгидразина. Это соединение является промежуточным продуктом в синтезе анальгина, а также антиаллергического препарата диазолин.
Дата добавления: 2015-09-04; просмотров: 588 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Общие методы получения фторорганических соединений | | | Диазотирование ароматических аминов |