
|
Читайте также: |
Уже более 100 лет известна реакция Грисса – диазотирование ароматических аминов с образованием солей диазония.

В 10 – 15 % соляной кислоте свободное основание амина находится в равновесии с гидрохлоридом амина, но в реакцию вступает только свободное основание. Так же как и при нитрозировании, атакующей электрофильной частицей является катион нитрозония, происходит образование нирозаммониевого катиона. Скорость этой стадии является лимитирующей. В большинстве случаев быстрыми стадиями являются потеря протона, образование нитрозамина, диазогидроксида и соли диазония.
Диазотирование алифатических аминов имеет свои особенности. В результате реакции также образуются соли диазония, однако они могут быстро превращаться в диазосоединения.

Если заместители R1, R2 являются электроноакцепторными, такими как CN, COOH, COOAlk, COR или NO2, то диазосоединения могут быть выделены в твердом виде. При электронодонорном характере заместителей соль диазония в водной среде быстро превращается в соответствующий спирт. Исключением является диазометан, который устойчив в растворе апротонных растворителей.
Не совсем обычное поведение и у солей диазония, которые получают из о - или п -аминофенолов. При изменении рН они обратимо превращаются в диазосоединения, имеющие тривиальное название – хинондиазиды.

При фотохимическом разложении хинондиазидов образуются карбены, вступающие в разнообразные реакции. Это свойство данных веществ находит применение при получении печатных плат в микроэлектронике (так называемые фоторезисты).
Аналогично соли диазония, полученные из аминоазолов, содержащих NH-фрагмент в цикле, также при повышении рН дают диазосоединения.
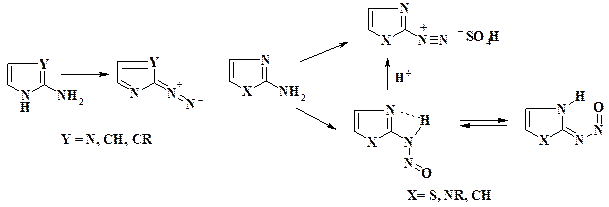
При отсутствии NH-фрагмента в цикле и некоторой электронодефицитности гетероядра реакция диазотирования может остановиться на получении нитрозамина, вероятно, за счет его стабилизации водородной связью. При диазотировании в крепкой серной и фосфорной кислотах или при действии их на нитрозамины образуются соли диазония.
В ряде случаев не удается получить диазосоединения из-за их быстрого превращения в гетероциклические соединения (см. также раздел 2.7):
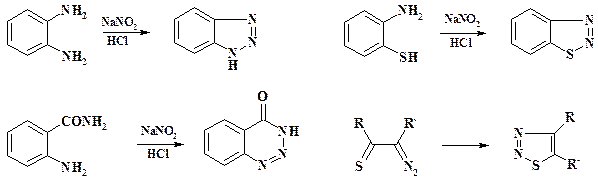
Таким образом в тех случаях, когда в о -положении к образующейся диазогруппе имеются реакционноспособные заместители (амино-, меркапто-, карбоксамидная, тиокарбоксамидная группы и т.п.), образуются соответствующие гетероциклы: бензотриазолы, бензотиадиазолы, бензотриазиноны и тиадиазолы. В сильных концентрированных кислотах некоторые из них могут дать соль диазония.
При растворении нитрита натрия в кислотах образуется сложнокомпонентная смесь (см. раздел 2.1.2):

Реакционная способность этих компонент уменьшается в следующем ряду: HOSO3NO > H2ONO+ > BrNO > ClNO > N2O3 >HNO2 > NO – нитрозилсерная кислота, протонированая азотистая кислота, нитрозилбромид, нитрозилхлорид, азотистый агидрид, азотистая кислота и оксиды азота.
Ароматические амины обычно диазотируют в 10 –20 % соляной кислоте, малоосновные производные анилина – в нитрозилсерной кислоте либо в соляной с добавкой бромистого калия. Это объясняется тем, что нитрозилсерная кислота и нитрозилбромид легче образуют катион нитрозония.
Диазотирование 2,4-динитроанилина удается провести в серной кислоте при медленном добавлении нитрозилсерной кислоты, полученной растворением нитрита натрия в конц. серной кислоте. Хорошие результаты были получены и при диазотировании в 85 % фосфорной кислоте, в растворе которой велика концентрация протонированной азотистой кислоты.
Соли диазония, как правило, хорошо растворимы в воде. При необходимости использования соли диазония в твердом виде ее выделяют в виде тетрафторбората (в реакции Шимана) или трихлороцинката.

Для проявления хроматограмм, содержащих вещества с фенольными группами, в частности каннабиолов (действующее начало марихуаны), применяют устойчивые соли диазония – диазосульфаниловую кислоту и «прямой синий прочный».
Для получения арилдиазоний хлоридов в твердом виде применяют диазотирование алкилнитритом в растворителе с сухим HCl.
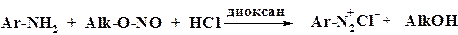
При обычном процессе диазотирования необходимо соблюдать следующие условия:
1) избыток кислоты на 1 моль диазотируемого амина должен быть не менее 2,5 – 3 молей;

При недостатке кислоты возникает дефицит нитрозирующего агента и непрореагировавший амин вступает в реакцию N- или С-азосочетания. Азоаминосоединение (триазен) при добавлении кислоты расщепляется на исходные компоненты. В случае образования азосоединения реакция является в обычных условиях односторонней и в результате этого чистый продукт получить не удается;
2) количество нитрита натрия должно быть близко к расчетному. Недостаток реагента ведет к получению диарилтриазена (азоаминосоединения), избыток приводит к частичному замещению диазониевой группы на нитрогруппу, давая примесь нитросоединения. Небольшое избыточное количество азотистой кислоты удаляют добавлением мочевины или сульфаминовой кислоты:
(NH2)2CO + 2 HNO2 = 2 N2 + 3 H2O + CO2
3) тепловой эффект экзотермической реакции диазотирования составляет 84 – 135 кДж/моль.

Соли диазония чрезвычайно чувствительны к нагреванию и при повышении температуры разлагаются до фенолов. В свою очередь фенолы могут вступать в реакцию с солями диазония с образованием азосоединений. Поэтому раствор соли диазония готовят непосредственно перед использованием в том же отделении цеха и при помощи эффективного охлаждения поддерживают низкую температуру реакционной массы: – 5 … + 15 – 20 oС.
Технология диазотирования. Яркийпример диазотирования дает М. Горький, описывая работу деда в красильной мастерской («Детство», приведено в химической интерпретации): «В деревянную 10–ведерную бочку заливают 2 ведра воды, 2 ведра конц. соляной кислоты и 12 фунтов амина. Размешивают деревянным веслом и засыпают 3 ведра битого льда. Ковшом добавляют приготовленный раствор нитрита натрия при непрерывном перемешивании». Конечно, никто в настоящее время так не работает. Но в данной технологии были все научные предпосылки. Материал реактора – дерево, а не сталь, т. к. реакционная масса высококоррозионноактивна. Эффективное охлаждение – добавление битого льда (кстати, и в настоящее время этот прием используют, зимой в России льда достаточно).
Реакцию проводят в эмалированной аппаратуре (стальной или чугунной) с лопастной или пропеллерной мешалкой, снабженной рубашкой и в некоторых случаях свинцовым змеевиком для охлаждения рассолом. Обычная технология получения фенилдиазоний хлорида: в емкостной эмалированный стальной или чугунный реактор с рубашкой для охлаждения рассолом из мерника заливают 15 % HCl и добавляют из мерника анилин. Реакционную массу размешивают, охлаждают до минус 1 – 2 оС плюс 5 oС и при поддержании этой температуры под слой жидкости из мерника медленно приливают 10 – 20 % раствор нитрита натрия. Строго контролируют температуру, при ее повышении добавление нитрита натрия прекращается. Конец реакции определяется появлением свободной HNO2, которую обнаруживают по скачку потенциала или с помощью йодкрахмальной бумажки. Раствор соли диазония передают на следующую, уже подготовленную операцию. Плохо растворимые в кислоте амины предварительно растворяют нагреванием в отдельном аппарате. Растворение в диазотаторе нецелесообразно, т. к. после прекращения подачи пара в рубашку остается конденсат, который будет разбавлять рассол, что приводит его в негодность.
Для труднодиазотируемых аминов, например 2,4-динитроанилина, необходимо использовать нитрозилсерную кислоту. В стальной или чугунный эмалированный аппарат из мерника заливают моногидрат и при 10 – 15 oС через люк добавляют мольное по отношению к амину количество нитрита натрия, нагревают до 80 oС (получение нитрозилсерной кислоты), охлаждают водой до 10 – 15 oС и постепенно добавляют тонко измельченный динитроанилин при той же температуре. По окончании диазотирования реакционную массу выливают на лед и фильтруют от непрореагировавшего амина. Для удаления избытка нитрозилсерной кислоты добавляют мочевину.
При проведении диазотирования аминосульфо- или аминокарбоновых кислот используют специальную технологию, так называемое «обратное диазотирование». В аппарате амин растворяют в щелочи и добавляют расчетное количество нитрита натрия. Из мерника постепенно добавляют соляную или разбавленную серную кислоту. Образуется тонкая суспензия амина, который и вступает в реакцию. Скорость процесса лимитируется растворением амина.
Дата добавления: 2015-09-04; просмотров: 537 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Синтез лекарственных средств | | | Строение солей диазония, реакционная способность |