
Читайте также:
|
В разделе 2.1.6 отмечалось, что энергия, выделяющаяся при взаимодействии элементарного фтора с углеводородами, вызывает разветвленную цепную реакцию. Причем величина энергии одного элементарного акта реакции выше энергии связи С-С. В результате этого основным продуктом взаимодействия является четырехфтористый углерод и возможен взрыв. Поэтому для получения фторорганических соединений необходимо использовать специальные методы. Их можно объединить в следующие группы:
1) окислительное фторирование фторидами металлов высшей валентности;
2) низкотемпературное взаимодействие алканов и алкенов с фтором, разбавленным инертным газом;
3) электрохимическое фторирование в среде фтороводорода;
4) получение фторорганических соединений с помощью фтороводорода и соединений общей формулы X-Fn;
5) превращение кето- и карбоксигрупп в дифтор- и трифторметильные группы;
6) замещение галогенов на фтор фтороводородом или фторидами металлов;
7) замещение диазониевой группы;
8) синтез новых веществ исходя из реакционноспособных фторорганических соединений.
Эти методы отличаются как по технологическому оформлению процесса, так и по получаемым результатам.
Окислительное фторирование фторидами металлов. Для получения перфторированных углеводородов широко используют фторирование соединений при высокой температуре в парах фторидами металлов высшей валентности. В промышленном производстве применяют CoF3. При этом трифторид превращается в дифторид кобальта. Обратный переход осуществляется пуском слабого тока фтора. Процесс ведут в псевдоожиженном слое. В качестве примера можно привести получение перфторгептана. Гептан пропускают первый раз через слой трифторида кобальта при температуре 175 – 200 oС. Конденсируют пары полученного продукта и при слабом токе фтора пропускают через псевдоожиженный слой второй раз при температуре 300 oС.

В аналогичных условиях из бензола получают перфторциклогексан. Таким образом удается «приручить» фтор и получать перфторированные продукты. Данным способом И.Я. Постовским и Б.Н. Лундиным синтезирована смазка УПИ-1, которая до сих пор используется в промышленности. В лаборатории удобнее использовать дифторид серебра.
Низкотемпературное взаимодействие алканов и алкенов с фтором, разбавленным инертным газом. Этот процесс в раннем варианте осуществляли в реакторе из горизонтально расположенных никелевых трубок, заполненных медными стружками. Реактор имел несколько температурных зон, от минус 78 oС до 0 oС. Внутри трубок небольшое количество субстрата контактирует с фтором, разбавленным гелием или азотом. Время контакта – от нескольких дней до недели с постепенным повышением концентрации фтора. Так были получены перфторадамантан, перфторизобутан и другие соединения. Однако способ не позволяет получать вещества в достаточно больших количествах.
Лучшие результаты дает аэрозольное низкотемпературное фторирование. Субстрат реакции наносят в виде аэрозоля на микрогранулы фторида калия и фторируют разбавленным фтором. Реактор состоит из модулей с различным температурным режимом. Этим способом получают перфторированные кетоны, например, перфторгепт-4-он:

Во многих случаях наблюдается изомеризация и деструкция:

Лучшие результаты получены при жидкофазном фторировании фтором, разбавленным большим количеством инертного газа:

Этим способом был получен 5-фторурацил. Однако, при относительно высоком выходе, чистота препарата не удовлетворяла требованиям Фармакопейной статьи.

Лучшие результаты получены при присоединении СH3COF по двойной связи молекулы урацила с последующим отщеплением уксусной кислоты под действием оснований или при нагревании. Этот метод вытеснил ранее использованный способ синтеза фторурацила из этилового эфира фторуксусной кислоты.
Электрохимическое фторирование в среде фтороводорода. В настоящее время производство некоторых перфторированных соединений основывается на электрохимическом фторировании в среде жидкого фтористого водорода. При данном способе фторирования углеводородов наблюдается их частичная деструкция, поэтому выделение индивидуальных веществ из смеси затруднено. Лучшие результаты получены при фторировании азот- и кислородсодержащих соединений. Электролизер снабжен обратным теплообменником, в котором конденсируются пары HF, катодное и анодное пространство разделяют полупроницаемой мембраной. В качестве материала электродов используют никель. Анодная плотность тока составляет 0,1 – 3 А/дм2, напряжение 4 – 8 В, температура 4 – 18 oС.
При фторировании карбоновых кислот образуются фторангидриды перфторкарбоновых кислот. Увеличение длины углерод-углеродной цепочки приводит к деструкции и уменьшению выхода целевых продуктов. В реакции чаще всего используют хлорангидриды, ангидриды или эфиры кислот:

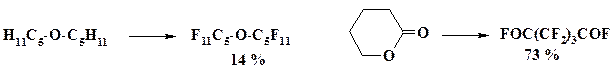
Неплохие результаты получены при фторировании простых эфиров и аминов, хотя и в этом случае наблюдается изомеризация.
Получение фторорганических соединений с помощью фтороводорода и соединений общей формулы X-Fn. Присоединение HF к двойным связям и оксиранам идет специфично. Присоединение фтористого водорода к стерически не затрудненным олефинам осуществляется по обычному механизму при температуре -80 – 0 oС в безводных условиях, т. к. вода конкурирует с фторид ионом при взаимодействии с карбокатионом. При повышении температуры наблюдаются побочные реакции полимеризации, перегруппировки и конденсации олефина с фтористым алкилом. Для присоединения HF к галогенолефинам требуется уже повышенная температура. При этом образуются ди- и тригалогеналкилы.
Большое техническое значение имеют реакции фторидов галогенов. При взаимодействии тетрафторэтилена с пентафторидом йода в присутствии йода при температуре 25 oС образуется пентафторйодэтан:

Реакция 1,1-дифторэтилена в тех же условиях дает 1,1,1-трифтор-2-иодэтан. Из тетрафторэтилена с трифторидом брома получают пентафторбромэтан. При взаимодействии бензола с трифторидом хлора образуется сложная смесь соединений: C6F11Cl, C6F10Cl2, C6F9Cl3, C6H5Cl, C6H4ClF и другие вещества.
Этот метод используют также и при получении фторированных стероидных гормонов. Синтез рассмотрен на примере кеналога:

К безводной HF в тетрагидрофуране медленно при температуре - 60 … - 30 oС добавляют стероид, растворенный в хлороформе. При более высокой температуре получают смесь 9-b и 11-b-фторпроизводных. Специфичнее и при нормальной температуре (10 – 20 oС) идет реакция с BF3, образующийся 9-b-F-11-b-О-дифторборат гидролизуют водой. Аналогично получают дексаметазон, триамциннолон (кенакорт) и синафлан. Замена водорода на фтор в 2 – 3 раза увеличивает активность стероидов.
Превращение кето- и карбоксигрупп в дифтор- и трифторметильные группы. Одним из значительных достижений химии фторорганических соединений было то, что четырехфтористая сера специфично замещает атом кислорода и серы на фтор. Так из спиртов получены монофтор-, из альдегидов и кетонов дифтор-, а из карбоновых кислот трифторметильные производные. Четырехфтористая сера позволяет гладко замещать хлор на фтор в ароматических и гетероароматических соединениях и в полигалогенпроизводных. В случае алифатических альдегидов и кислот из-за наличия енольных форм можно получить смесь целевого продукта с продуктами разложения. Побочную реакцию подавляют добавкой фтороводорода и трехфтористого бора. Из бензойной кислоты при температуре 150 oС получен бензо-трифторид. Из фталевого ангидрида и терефталевой кислоты синтезированы соответствующие гексафторксилолы. Из бензальдегида в тех же условиях образуется дифтортолуол. При взаимодействии п -бензохинона с четырехфтористой серой получен 1,2,4-трифторбензол. Из урацил-5-карбоновой кислоты в синтезе трифтортимидина получают 5-трифторметилурацил:

Избыток четырехфтористой серы составляет 8 молей. Катализирует процесс добавка небольшого количества воды. Из 2,4-дихлорпиримидина образуется в тех же условиях дифторпроизводное. Взаимодействие четыреххлористого углерода с этим реагентом при температуре около 300 oС приводит к трифторхлорметану и дифтордихлорметану (фреон–12).
Замещение галогенов на атом фтора фторидами металлов или фтороводородом. Безводный фтороводород легко замещает атом хлора в соединениях, содержащих трихлорметильную группу. При взаимодействии бензотрихлорида, образующегося в качестве побочного продукта при радикальным хлорировании толуола, с HF при 0 oС получается с 95 % выходом бензотрифторид.
C6H5-CCl3 + 3 HF → C6H5-CF3 CCl2=CCl-CCl3 → CCl2=CCl-CF3
Способ используют для синтеза 1,1,2-трихлор-3,3,3-трифторпропилена. Мягким реагентом для замещения хлора на фтор является трехфтористая сурьма. Промышленное производство фреона–12 осуществляют из четыреххлористого углерода с SbF3:
CCl4 + SbF3 → CCl2F2.
Процесс ведут непрерывным методом в каскаде автоклавов при температуре 100 oС. Фреоны нашли широкое применение в качестве хладагентов в холодильной технике, теплоносителей в нетрадиционных методах получения электроэнергии (гидротермальные источники, солнечные радиаторы), а также в качестве экстрагентов. Для экстракции каротина из культуральной жидкости используют хладон (Ф-113). Фреоны химически инертны и нетоксичны. Инертность имеет положительное значение при эксплуатации, но это свойство становится экологической проблемой. По ряду данных фреоны, выбрасываемые в атмосферу, вызывают разрушение озонового слоя Земли. Однако образование озоновых дыр в приполярных областях Земли объясняют также и естественными причинами.
Синтез дифторхлорметана из хлороформа является также одним из важнейших технических процессов. Дихлорфторметан используют в качестве интермедиата в производстве тетрафторэтилена, из которого производят политетрафторэтилен (тефлон, тефлон-4, фторопласт-4). Процесс замещения атомов хлора на фтор отличается от производства фреона-12. Реакцию ведут в растворе SbCl5 в безводном фтороводороде при их соотношении 1:13. Производство также непрерывное.
CHCl3 + HF + SbCl5 → CHClF2 + CHF3
Для предотвращения образования трифторметана, который не имеет сбыта, реакцию проводят при более низкой температуре. В первом реакторе температура 60 – 70 oС, а в последнем не выше 30 oС. В аналогичных условиях из гексахлорэтана синтезируют 1,1,2-трихлор-1,2,2-трифторэтан – сырье для производства дифторхлорэтилена, из которого получают фторопласт-3. При использовании хлоридов сурьмы в безводной HF необходимо учитывать как реакционную способность субстрата реакции, так и то, что наименее активным реагентом является SbF3, а наиболее реакционноспособным SbF5. Промежуточной активностью обладает SbF3Cl2.
При замещении атомов хлора на фтор наиболее широко используется безводный фторид калия. Фториды других щелочных металлов обычно не применяют в промышленности из-за того, что активные реагенты CsF и RbF дороги, а более дешевый фторид натрия трудно растворим. Для проведения процесса очень важен выбор растворителя. В водных растворах и в протонных растворителях ион фтора гидратирован или сольватирован. Энергия гидратации составляет 103 ккал/моль, из-за этого в воде фторид ион является очень слабым нуклеофилом. Термодинамический анализ показывает, что хлор в алкилгалогенидах в таких условиях не будет замещаться на фтор. Поэтому необходимо использовать тщательно высушенный фторид калия. Кроме того, для лучшей растворимости используют супердисперсный реагент. Наилучшие результаты достигнуты в таких апротонных растворителях, как ДМСО, ДМФА, N-метилпирролидон (НМП, NMP) и цис -тетраметилсульфон (сульфолан). Для высокореакционных субстратов реакция идет гладко и в ацетонитриле. Температура проведения процесса зависит от реакционной способности субстрата и от растворителя. Так при замещении атома хлора на фтор в 2,4-динитрохлорбензоле реакция с фторидом калия в нитробензоле идет при температуре 195 oС, а в ДМФА и ДМСО хорошие результаты получены уже при 100 oС. В отсутствие электроноакцепторных заместителей необходимо повышать температуру проведения процесса. Так при взаимодействии октахлорциклопентена с суспензией KF в NMP при температуре 200 oС образуется октафторциклопентен:

В более жестких условиях осуществляется замещение хлора на фтор в ароматическом ядре, не содержащем сильных электроноакцепторных заместителей. Так при взаимодействии гексахлорбензола с фторидом калия при 240 oС в метилпирролидоне образуется следующая смесь соединений:

При использовании супердисперсного фторида калия в ДМФА при температуре 280 oС основным продуктом является пентафторхлорбензол (68 %). Замещение атомов хлора на фтор в пиридиновом цикле идет легче в положениях 2, 4 и 6, электронная плотность в которых меньше, чем у атомов углерода в положениях 3 и 5. Реакцию ведут в N-метилпирролидоне при 240 – 250 oС.
Замещение всех атомов хлора происходит в жестких условиях – при 400 – 500 oС.

Для превращения 2-хлорпиридина в 2-фторпиридин требуются более мягкие условия.

В настоящее время синтетические препараты фторхинолонового ряда заняли прочные позиции на фармацевтическом рынке, потеснив традиционно используемые антибиотики и другие группы антибактериальных препаратов. Ключевыми интермедиатами при получении фторхинолонов являются фторсодержащие производные анилина или бензойной кислоты.

В приведенном синтезе осуществляют замещение только одного атома хлора в п- положении к нитрогруппе в мягких условиях.
В альтернативном синтезе пефлоксацина используют не фторхлоранилин, а дифторанилин, который получают по следующей схеме:

Для замещения двух атомов хлора приходится повышать температуру. Синтез исходного 2,4-дихлор-3-фторнитробензола осуществляют из аминопроизводного с помощью реакции Шимана. Тетра- и пентафторбензойную кислоту получают из тетрахлорбензодинитрила и пентахлорбензонитрила. Использование ангидрида исключается, т. к. при взаимодействии тетрахлорфталевого ангидрида с фторидом калия образуется с 65 % выходом октафторантрахинон. Предполагают, что во время реакции происходит декарбоксилирование, а образовавшийся тетрафторбензол реагирует с дифторангидридом тетрафторфталевой кислоты.



Существенно в более мягких условиях идут реакции фторида калия с эфирами сульфокислот, сульфогалогенидами, хлорангидридами кислот и галогенидами фосфора.
R-CH2-O-SO2-Ar + KF → R-CH2-F + Ar-SO3K
Реакцию эфиров бензолсульфокислоты с фторидом калия проводят при нагревании до 60 oС в ацетоне.
В сульфохлоридах реакция замещения идет даже в водном растворе при 20 – 40 oС:
CH3SO2-Cl + KF + H2O → CH3SO2-F
Фторангидриды кислот легко получают с фторидом калия или кислым дифторидом калия при температуре 100 oС в течение 1 ч из хлорангидридов:
CH3-(CH2)3-COCl + KHF2 → CH3-(CH2)3-CO-F
Полученный продукт из реакционной массы отгоняют. Другим вариантом этого процесса является взаимодействие кислоты с хлорангидридом бензойной кислоты и фторидом калия. Так удалось получить даже фторангидрид муравьиной кислоты при температуре 100 oС:
HCOOH + C6H5COCl + KF → HCOF
Еще легче идет замещение атомов хлора в соединениях хлористого фосфора. Так при получении необратимых ингибиторов холинэстеразы – алкилфторфосфатов, например зарина, реакцию проводят в протонном растворителе при 60 oС:

Это так называемый «салин-процесс». Замещение атома хлора на фтор идет гладко с фторидом натрия. При замене изопропильного радикала остатком холина существенно возрастает сродство соединения с холинэстеразой. Летальная доза для зарина составляет 0,05 мг/кг, а для V-газов она понижается на один – два порядка.
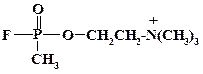
В дизайне данного соединения заложено тонкое понимание взаимосвязи структуры и действия. Остаток холина занимает контактный центр фермента. Метилфторфосфатный фрагмент точно имитирует ацетильный остаток метаболита. Атом фтора за счет своего «маскирующего эффекта» не препятствует контакту соединения с ферментом. Соответствующий хлорфосфат не является отравляющим веществом, т. к. радиус хлора значительно больше и это вещество не способно занять реакционный центр. Фторфосфаты способны реагировать с такими нуклеофилами, как аминогруппа белка. Образование ковалентной связи N-P приводит к необратимому ингибированию фермента. Способность фторфосфатов реагировать с нуклеофилами используют для дегазации. Обработка оборудования или местности слабым раствором щелочи приводит к надежной дегазации в течение несколько часов.
Реакции с фторидами металлов более региоселективны, чем прямое фторирование органических веществ.
Замещение диазониевой группы. Одним из методов синтеза моно- и дифторзамещенных ароматических и некоторых гетероциклических соединений является замещение диазониевой группы на фтор – реакция Шимана. Процесс имеет несколько модификаций. Самый простой способ – диазотирование ароматического амина в концентрированной плавиковой кислоте с последующим нагреванием, дает неудовлетворительные результаты, выход целевого продукта незначителен. В основном образуются соответствующие фенолы, т. к. гидратированный фторид ион является очень слабым нуклеофилом. Лучшие результаты получены при диазотировании твердым нитритом натрия в безводной HF:

Этим способом производят в промышленности фторбензол, выход составляет 75 %. Выход п- фторбензойной кислоты практически количественный. Впервые, еще до открытия реакции Шиманом и Бальдом, диазогруппу удалось заменить на фтор с помощью разложения триазена.

Фенилдиазоний хлорид на первой стадии реагирует с пиперидином, триазен выделяют и проводят реакцию при низкой температуре в концентрированной HF. В настоящее время арил- и гетарилфториды получают термическим разложением тетрафторборатов диазония. Для проведения реакции необходимо тщательно сушить тетрафторбораты. Однако, как отмечалось в разделе 2.4, при сушке необходимо соблюдать максимальную осторожность, т. к. сухие соли диазония взрывоопасны. Механизм реакции Шимана гетеролитический:
Ar-N2+ BF4- → Ar+ + F- + BF3 + N2 → Ar-F
Если разложение тетрафторбората фенилдиазония проводить в растворителе, например в нитробензоле, то образуется 3-нитродифенил, а не фторбензол, что подтверждает механизм процесса. При разложении тетрафторбората п- нитрофенилдиазония при термолизе в ячейке ЭПР спектрометра наблюдалось образование радикальных частиц. Наиболее вероятно, что их появление является результатом побочной реакции. Температуру проведения процесса выбирают в зависимости от структуры субстрата. При разложении тетрафторбората нитрофенилдиазония необходимо субстанцию разбавлять песком, поскольку реакция идет очень бурно. В ранее рассмотренном примере получения 2,3,4-трифторнитробензола на первой стадии проводят диазотирование 3-амино-2,4-дихлорнитробензола в борфтористоводородной кислоте, соль диазония сушат, термолиз ведут в песке, трехфтористый бор улавливают. При проведении реакции Шимана в гексаметилтриамидофосфате (гексаметаполе) удается избежать бурного протекания реакции. Разложение солей диазония, содержащих электронодонорные заместители, может быть проведено в водном растворе:

В качестве катализатора используют медный порошок. В случае неустойчивых солей диазония синтез фторпроизводного удается провести только в растворе. Например, при диазотировании 2-аминопиридина реакцию проводят в борфтористоводородной кислоте. После окончания диазотирования температуру реакционной массы повышают с 10 oС до 40 oС. Образовавшийся фторпиридин отгоняют с паром, выход целевого продукта 32 %.

Наиболее сложной проблемой при получении фторпроизводных с использованием реакции Шимана является работа с сухими тетрафторборатами арилдиазония из-за их высокой взрыво- и пожароопасности.
В некоторых случаях использование вместо тетрафторбората гексафторфосфата позволяет повысить выход конечного продукта.

Разложение о- бромфенилдиазоний гексафторфосфата идет при более низкой температуре и о- бромфторбензол образуется с выходом 78 %, вместо 34 % из тетрафторбората.
Синтез новых веществ из реакционноспособных фторорганических соединений. Большое разнообразие промышленных фторированных продуктов обеспечивается производством их из реакционноспособных интермедиатов. К таким веществам в первую очередь относится тетрафторэтилен.
CHClF2 → [F2C:] → F2C=CF2
Это соединение получают пиролизом дифторхлорметана (фреона–22) при 600 – 700 oС, при этом происходит дегидрохлорирование с образованием дифторкарбена, который димеризуется.
Если проводить реакцию дегидрохлорирования в присутствии перехватчика дифторкарбена, то получают смесь дифторбензолов, из которой с выходом 25 % выделяют о- дифторбензол.
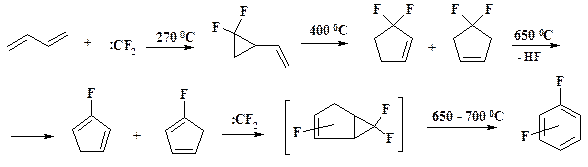
Этот уникальный процесс разработан под руководством академика РАН О.М. Нефедова. Организовано производство о- дифторбензола, исходного сырья в синтез препарата пефлоксацин.
Наиболее крупнотоннажным производством является получение тетрафторэтилена (ТФЭ), большая часть которого идет на получение политетрафторэтилена. Тефлон обладает уникальными свойствами, из-за которых его называют «органическая платина». Он не разрушается при кратковременном нагревании до 400 oС, а максимальная температура непрерывной эксплуатации изделий из него составляет 260 oС. Полимер не реагирует с большинством реагентов, не поглощает влагу и не смачивается водой, обладает малой адгезией и имеет очень низкий коэффициент кинематического трения. Наряду с ТФЭ термическим дехлорированием трихлортрифторэтана (фреона-113) получают трифторхлорэтилен, полимеризация которого дает фторопласт-3. В настоящее время выпускается ряд сополимеров ТФЭ с перфторалкилтрифторвиниловым эфиром, гексафторпропиленом и этиленом. Из ТФЭ синтезируют широкий ряд соединений, использующихся в качестве промежуточных продуктов.

В данном разделе приведены лишь некоторые превращения, представляющие интерес для создания новых лекарственных средств. Они представлены на схеме без указания условий проведения процесса, с которыми можно ознакомиться в специальной литературе.
В процессах теломеризации всегда образуется смесь соединений с n = 2 – 10, но из-за различных температур кипения продуктов с помощью ректификации удается получить индивидуальные вещества достаточной степени чистоты.
Дата добавления: 2015-09-04; просмотров: 661 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| ПОЛУЧЕНИЕ ФТОРОРГАНИЧЕСКИХ СОЕДИНЕНИЙ | | | Синтез лекарственных средств |