
|
Читайте также: |
A – абсолютная работа, Q – теплота. В дальнейшем будем использовать их удельные величины  с теми же обозначениями.
с теми же обозначениями.
Работа бывает не только механической, но и немеханической (например, работа химических реакций).
Работа и теплота – единственные формы передачи энергии. Это одна из формулировок I-го начала термодинамики. Установлено, что внутренняя энергия U является однозначной функцией всей совокупности координат состояния системы, то есть U = U(x1, x2,…,xn).
Если бы это условие не выполнялось, то стал бы возможен вечный двигатель первого рода – двигатель, творящий работу без подвода энергии извне.
Цикл - это круговой процесс, в котором система возвращается в первоначальное состояние. Если цикл идёт по часовой стрелке, то он называется прямым, а если против – обратным.

рис.5. Произвольный прямой обратимый цикл.
Для произвольного обратимого цикла (рис.5)
DU1-а-2-б-1 = 0 или
 (28)
(28)
Из математики известно, что равенства вида 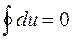 означают наличие под знаком интеграла полного дифференциал функции U. В любом произвольном процессе изменение внутренней энергии от состояния 1 до состояния 2 определяется ее начальными и конечными значениями, таким образом внутренняя энергия является функцией состояния:
означают наличие под знаком интеграла полного дифференциал функции U. В любом произвольном процессе изменение внутренней энергии от состояния 1 до состояния 2 определяется ее начальными и конечными значениями, таким образом внутренняя энергия является функцией состояния:
 (29)
(29)
Примером функции состояния из другой области является потенциальная энергия Eпот=mgH, величина которой не зависит от траектории подъёма или опускания груза на высоту H.
Ранее было получено I-ое начало термодинамики в общем виде:

Исходя из того, что единственным источником теплоты и работы является внутренняя энергия системы (U), выделим в правой части этого выражения отдельное слагаемое dQ, соответствующее тепловому взаимодействию:
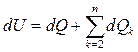 .
.
Как было установлено в ходе развития науки, для всех взаимодействий, кроме теплового, справедливо соотношение:
dAk = –dQk,
где Ak – абсолютная работа при k-ом взаимодействии (механическая и немеханичекская). Тогда 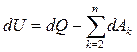 . Введем обозначение
. Введем обозначение  и окончательно получим I-ое начало термодинамики в обычной форме
и окончательно получим I-ое начало термодинамики в обычной форме
dQ = dU + dA (30)
Проинтегрируем уравнение (30) и выразим Q
Q = ∆U + A (30*)
Таким образом, подведенная к системе теплота идет на изменение ее внутренней энергии и на совершение системой абсолютной работы.
Исследуем принадлежность A и Q к функциям состояния. Так как  .
.
Возможны два варианта:
- оба круговых интеграла имеют нулевые значения;
-  , при
, при 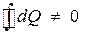 и
и  .
.
Для простоты рассмотрим деформационную систему, которая, как известно, имеет одну (деформационную) степень свободы. Рассмотрим абсолютную работу в произвольном цикле, который совершает эта система.
 | |||
 | |||









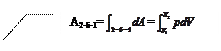










|

 |
рис.6. Произвольный цикл деформационной системы.
Как известно, геометрический смысл интеграла  - это площадь под кривой y = y(x) на отрезке x1-x2. Из рис.6. для произвольного цикла видно, что площадь 1-а-2 в общем случае не равна площади под кривой 2-б-1, поэтому
- это площадь под кривой y = y(x) на отрезке x1-x2. Из рис.6. для произвольного цикла видно, что площадь 1-а-2 в общем случае не равна площади под кривой 2-б-1, поэтому

Окончательно  и (31)
и (31)
соответственно,  (31*)
(31*)
Таким образом, A и Q не являются функциями состояния, а являются функциями процесса.
Дата добавления: 2015-09-01; просмотров: 160 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| I.5. Реальные свойства газа. Уравнение состояния реального газа. | | | I.7. Характеристические функции. |