
|
Читайте также: |
Система – тело или совокупность тел, являющихся объектов изучения.
Окружающая среда – все остальные тела.
Процесс – изменение физических параметров системы, проявляющиеся в изменении ее термодинамических параметров состояния.
Например, если объектом изучения является газ в цилиндре под поршнем, то системой является газ, а все остальное – окружающая среда.
Координатой состояния системы называется величины, которая всегда изменяются при наличии данного взаимодействия, и остается постоянной при его отсутствии. Другими словами, координата состояния системы – это индикатор наличия или отсутствия данного взаимодействия.
Изменение величины, вызываемой координатой, свидетельствует о наличии соответствующего процесса.
xk – общее обозначение координаты состояния при k-ом взаимодействии.
Примеры координат состояния системы:
Пример 1. При деформационном (механическом) взаимодействие всегда изменяется объём W, м3. В инженерных расчетах и формулах термодинамики в основном используется удельный объем системы v, 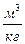
 , где m – масса системы, кг.
, где m – масса системы, кг.
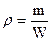 - плотность.
- плотность.
Таким образом, Xдеф – это удельный объем v.
Пример 2. Тепловое (термическое) взаимодействие:
При тепловом взаимодействии всегда имеет место обмен теплотой между системой и окружающей средой. В ходе развития науки было установлено, что координатой xтепл является энтропия  . В расчетах в основном используется удельная энтропия S
. В расчетах в основном используется удельная энтропия S

Энтропия, как параметр системы, на опыте не определяется, так как нет прибора для ее измерения. Значение энтропии вычисляются по формулам термодинамики, которые будут рассмотрены далее.
Общее определение энтропии – это мера неупорядоченности системы. Чем больше беспорядок, тем больше энтропия.
Как будет показано далее, изменение энтропии в изотермическом процессе характеризует подведенное или отведенное количество теплоты (QT = T∙∆S).
Таким образом, Xтепловое(термическое) – это S.
Пример 3. Химические реакции и фазовые превращения:
При них всегда изменяется масса компонентов системы (исходных веществ, продуктов реакции и т.д.)
mi – масса i-го компонента системы.
Таким образом Xх-ф - это mi.
Потенциал – это величина, разность которой у системы и окружающей среды вызывает процесс. Общее обозначение:
Pk – потенциал при k-том взаимодействии.
 - потенциал окружающей среды при k-том взаимодействии;
- потенциал окружающей среды при k-том взаимодействии;
Pki – потенциал системы при k-том взаимодействии.
Правило знаков для потенциалов:
Разность потенциалов между окружающей средой и системой считается положительной, если соответствующая координата при этом возрастает, и наоборот.
 , если dxk > 0
, если dxk > 0
 , если dxk < 0
, если dxk < 0
Найдем величины, которые являются потенциалами при наиболее распространенных взаимодействиях:
Пример 1. Деформационное взаимодействие.
Если давление над поршнем (pн) будет больше давления под поршнем (pвн), то удельный объем системы будет уменьшаться, то есть
при  , dV<0
, dV<0





газ
(система)
рвн,v
 |
рис.1
Из этого примера следует, что давление, как потенциал, при деформационном взаимодействии не соответствует правилу знаков.
Правило знаков будет выполняться, если брать давление со знаком минус.
Таким образом,Pдеф – это (-p), Па
Во всех формулах термодинамики используется только абсолютное давление р.
Манометры показывают рман, то есть превышение давления в системе над атмосферным (барометрическим) давлением В, поэтому p = pман +В.
Если в системе имеется разрежение (вакуум), то абсолютное давление определяется по формуле р= B – pвак,
где pвак – показания вакуумметра.
Поправки для ртутных приборов:
При измерении давления ртутными приборами в мм.рт. столба следует иметь в виду, что показания этих приборов (ртутного манометра, барометра) зависят не только от величины измеряемого давления, но и от температуры ртути в приборе. При положительных температурах плотность ртути меньше, удельный объём выше, следовательно, показания приборов будут выше, чем при 0°C. При температурах ниже 0°C соотношение будет обратным. Показания ртутных приборов для измерения давления всегда приводятся к 0°C.
| Температуры столба ртути | |||||||
| Поправка на 1000 мм.рт.ст. | 0,87 | 1,73 | 2,59 | 3,45 | 4,31 | 3,17 |
Для ртутного барометра, кроме таблицы поправок, также используется формула
B0 = B(1-0.000172 t), где
где, B0 – барометрическое давление, приведенное к 0°C;
B – показания барометра при температуре ртути t°C.
Если t>0, то поправку вычитают, если t<0 – прибавляют.
Пример 2. Тепловое взаимодействие.
Как показывает опыт, теплообмен возможен только при наличии разности температур между системой и окружающей средой. В качестве такой температуры в термодинамики используется абсолютная термодинамическая температура Т, К
T = t°C + 273,15
t°F =  t°C + 32
t°C + 32
Температура по шкале Фаренгейта (t°F) в термодинамике не используется.
Наиболее точно абсолютная температура определяется по показаниям газовых термометров.
Пример 3. Химические и фазовые превращения.
В ходе развития науки было установлено, что потенциалом при химических и фазовых взаимодействиях является величина химического термодинамического потенциала μх-ф.
Большинство химических реакций и фазовых превращений протекает при одновременном постоянстве двух параметров. Например, при постоянных р и Т в термодинамике μх-ф обозначается как µр,Т и называется изобарно-изотермическим потенциалом.
Дата добавления: 2015-09-01; просмотров: 147 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Раздел I. Особенности термодинамики, как науки. | | | I.2. Теплота, работа, внутренняя энергия. |