
Читайте также:
|
Каждому взаимодействию данного рода соответствует своя координата и свой потенциал, как было показано ранее. Так, для термодеформационной системы можно записать четвёрку параметров:
| x | S | v |
 P P
| T | -p |
Если система имеет n термодинамических степеней свободы, то есть допускает n взаимодействий различного рода, то для такой системы можно записать n координат x1, x2,…,xn и, соответственно, n потенциалов: P1, P2,…,Pn.
Совокупность координат и потенциалов общим числом 2n называется термодинамическими параметрами состояния системы.
Пример. Для термодеформационной системы n = 2, так как система допускает тепловое и деформационное взаимодействии.
Как было установлено в ходе развития термодинамики, вся совокупность координат состояния системы полностью характеризует состояние системы. Так, внутренняя энергия системы
U = U(x1, x2,…,xn)
Потенциалы также являются однозначными функциями всей совокупности координат системы, то есть
Pk = Pk(x1, x2,…,xn) (13)
Уравнение (13) называется уравнением состояния системы в общем виде.
Рассмотрим термодеформационную систему, для которой (13) запишется как два уравнения:
T = T(S, v) и p = p(S, v).
Так как приборов для измерения энтропии нет, то желательно энтропию из этих уравнений исключить. Выразим S из первого уравнения, подставим во второе и окончательно получим
F(p, T, v) = 0 (14)
Уравнение (14) называется уравнением состояния термодеформационной системы в общем виде. Конкретный вид этого уравнения состояния системы классическая термодинамика вследствие макроскопичности получить не может и вынуждена заимствовать у других наук.
Из физики известно уравнение состояния идеального газа (уравнение Менделеева-Клапейрона):
pv = RT (15)
Здесь, R, 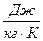 удельная газовая постоянная. R является индивидуальной характеристикой газа, содержится в справочной литературе или вычисляется через универсальную газовую постоянную
удельная газовая постоянная. R является индивидуальной характеристикой газа, содержится в справочной литературе или вычисляется через универсальную газовую постоянную 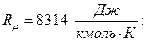
R = 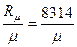 ,
, 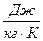 (16)
(16)
где μ – молярная масса.
Например, для воздуха μ = 28,96 и R= 8314/28,96= 287 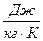
Идеальный газ– это газ, молекулы которого не имеют объёма, отсутствуют силы межмолекулярного притяжения и ассоциации молекул. Таким образом, идеальный газ – это научная абстракция, в природе его нет.
При малых давлениях и высоких температурах любой газ можно условно считать идеальным и применять к нему уравнение состояния идеального газа. Чем выше давление и ниже температура, тем больше свойства газа отклоняются от свойств идеального газа. Уравнением (15) рекомендуется пользоваться, если давление газа не превышает 3 МПа. Чем выше давление, тем выше погрешность уравнения Менделеева-Клапейрона.
Уравнение состояния идеального газа записывется в различных формах.
pvμ = RμT (17)
Уравнение (17) было получено Д.И. Менделеевым;
Здесь, vμ – молярный объём. Удельный объем и молярный объем связаны между собой соотношением
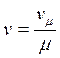 (18)
(18)
Если подставить в уравнение (17) соотношения (18) и (16), то получим pv = RT. В таком виде уравнение состояния идеального газа получил Клапейрон.

pW = MRT (19)

М – масса системы, кг; W – объем системы, м3.
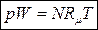 (20)
(20)
где 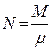 – число киломолей вещества системы.
– число киломолей вещества системы.
Киломоль – это количество вещества в килограммах, численно равное его молекулярной массе. Например, 1 кмоль воздуха (µ = 28,96) имеет массу 28,96 кг.

p = ρRT (21)

где ρ = 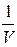 , плотность,
, плотность, 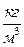 (22)
(22)
Дата добавления: 2015-09-01; просмотров: 158 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| I.3. Равновесные и неравновесные взаимодействия. Статические и нестатические процессы. | | | I.5. Реальные свойства газа. Уравнение состояния реального газа. |