
Читайте также:
|
Однородными называются системы, у которых в различных их частях свойства одинаковые.
Теплоёмкостью называется количество теплоты, необходимое для изменения температуры единицы количества вещества на 1°.
В зависимости от того, что является единицей измерения количества вещества, различают:
1) массовую (удельную) теплоёмкость 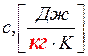 ;
;
2) мольную (молярную) теплоёмкость  ;
;
Примечание:
1 Кмоль – это количество вещества в килограммах, численно равное его молекулярной массе. Например, у сухого воздуха  =28,96 и соответственно его 1 Кмоль имеет массу 28,96 кг.
=28,96 и соответственно его 1 Кмоль имеет массу 28,96 кг.
3) объёмную теплоёмкость 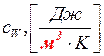 .
.
Так как объём вещества зависит от давления и температуры, то объёмные теплоёмкости в справочной литературе, как правило, даются для нормальных физических условий:
рнорм = 101325 Па
Тнорм = 273,15 К
Перечисленные выше теплоемкости, связаны между собой следующими соотношениями
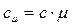 (70)
(70)
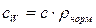 (71)
(71)
Из уравнения состояния идеального газа
rнорм = 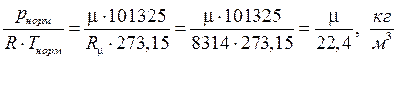
Как следует из определения теплоёмкости 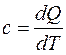 , ее величина зависит от вида процессов. Как было показано ранее, теплота
, ее величина зависит от вида процессов. Как было показано ранее, теплота 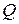 является функцией процесса, поэтому и теплоемкости также подразделяются по видам термодинамических процессов на изохорную, изобарную, изотермическую, адиабатную теплоемкости и теплоемкость в политропном процессе.
является функцией процесса, поэтому и теплоемкости также подразделяются по видам термодинамических процессов на изохорную, изобарную, изотермическую, адиабатную теплоемкости и теплоемкость в политропном процессе.
Теплоемкости изопроцессов являются теплофизическими характеристиками вещества и их значения содержатся в справочниках, но значения изотермических теплоемкостей и адиабатных не приводятся, потому что из определения теплоемкости 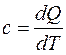 следует:
следует:
cT = сmT = cWT = 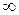 ;
;
cs = сms = cWs = 0.
Таким образом для изохорного процесса (V=const) используются:
cv – массовая изохорная теплоёмкость (теплоемкость в изохорном процессе).
сmv – молярная (мольная) изохорная теплоёмкость;
cWv – объёмная изохорная теплоёмкость.
Для изобарного процесса (p=const) используются:
cp – массовая изобарная теплоёмкость.
сmp – молярная (мольная) изобарная теплоёмкость;
cWp – объёмная изобарная теплоёмкость.
Теплоемкость политропного процесса рассматривается далее в разделе IV.
Дата добавления: 2015-09-01; просмотров: 198 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| I.8. Дифференциальные соотношения термодинамики. | | | II.2. Общая формула теплоёмкостей однородных систем. |