
Читайте также:
|
Обозначим через Qk количество взаимодействия - меру взаимодействия между системой и окружающей средой. Так, при тепловом взаимодействии, количеством взаимодействия является теплота. Размерность Qk зависит от вида взаимодействия.
Обозначим через Q, 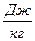 удельную теплоту, которой обмениваются окружающая среда и система.
удельную теплоту, которой обмениваются окружающая среда и система.
Обозначим через A, 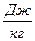 удельную абсолютную работу. Работа А подразделяется на механическую и немеханическую.
удельную абсолютную работу. Работа А подразделяется на механическую и немеханическую.
Абсолютная деформационная работа в координатах рv изображается графически как площадь под кривой (прямой) процесса по отношению к оси v.
 |
Р
 |
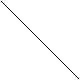

 Р1 1
Р1 1
 |


 Р2 2
Р2 2
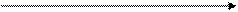 V1 V2 V
V1 V2 V
рис.2
Примечание: кроме абсолютной работы А в термодинамике также используется понятие располагаемой (полезной) работы Апол - работы, которая может быть «передана» другой системе. Графически работа Апол также изображается как площадь под кривой, но по отношению к оси р
Примеры немеханической работы:
1) работа химических реакций;
2) работа электрических сил.
В ходе развития термодинамики было установлено, что единственными формами передачи энергии являются теплота и работа. Строго говоря, работа и теплота это не виды энергии, так как проявляются только в процессе передачи энергии.
Обозначим через U, 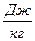 удельную внутреннюю энергию системы.
удельную внутреннюю энергию системы.
Внутренняя энергия включает в себя кинетическую энергию поступательного и колебательного, вращательного движения молекул, потенциальную энергию межмолекулярного взаимодействия, а также химическую и атомную энергию.
Обозначим через Е, Eкин, Ep соответственно полную, кинетическую и потенциальную энергию системы:
E = Eкин + Ep + U.
В термодинамике все результаты получены для случая, когда
Eкин = 0 и Ep = 0, таким образом полагается, что полная энергия системы равна внутренней, то есть:
E = U.
В ходе развития термодинамики были установлены соотношения:
dQk = 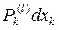 (1)
(1)
dAk = – dQk = – 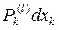 (2)
(2)
Например, при тепловом взаимодействии:
dQ = T dS (3)
При деформационном:
dAдеф = – dQk = 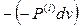 =
=  (4)
(4)
У системы с E = U все взаимодействия системы с окружающей средой сопровождаются изменением внутренней энергии системы, то есть математически это выражается следующей формулой:
dU = 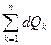 =
= 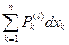 (5)
(5)
Формула (5) - первое начало термодинамики в обобщённом виде.
Здесь n – число термодинамических степеней свободы системы, т.е. количество взаимодействий разного рода, которые допускает данная система.
Например, у деформационной системы есть только одна степень свободы, а именно деформационная (механическая). Для такой системы первое начало термодинамики запишется в следующем виде:
dU = dQдеф = - р(l)dv (6)
Система, которая допускает ее деформирование и теплообмен с окружающей средой называется термодеформационной системой (тепломеханической). У такой системы две степени свободы (n=2):
dU = dQдеф + dQ (7)
Так как dQдеф = -dAдеф , а dQ = T(l)dS уравнение (5) примет следующий вид:
dU = p(l)dv+ T(l)dS (8)
Уравнение (8) - это первое начало термодинамики для термодеформационной системы.
Дата добавления: 2015-09-01; просмотров: 141 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| I.1. Основные определения термодинамики. | | | I.3. Равновесные и неравновесные взаимодействия. Статические и нестатические процессы. |