
|
Читайте также: |
А+2В→…
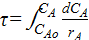 ;
; 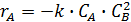 ;
;
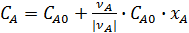 ;
; 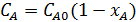 ;
;
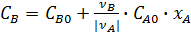 ;
; 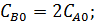
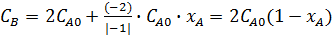 ;
;
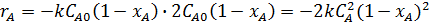 ;
;
τ = 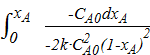 ;
;
τ = 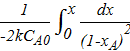 =
= 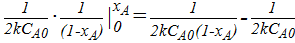 =
=
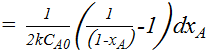 ;
;
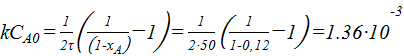 ;
;
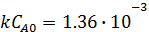 ;
;
xA = xB = 0.12;
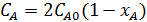 ;
;
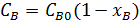 ;
;
 =
= 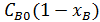 ;
;
После преобразований получено следующее выражение:
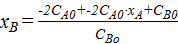 =
= 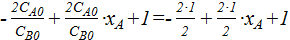 =
= 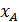 ;
;
Уравнение для РИВ:
τ = 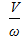 =
= 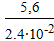 = 233 сек;
= 233 сек;
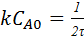 (
(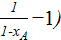 ;
;
1,36∙10-3 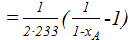 ;
;
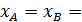 0,388.
0,388.
Уравнение для РИС, 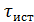 такое же.
такое же.
Вывод характеристического уравнения.
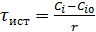 ;
;
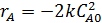 (1-
(1- 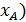 ;
;
233 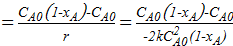 =
= 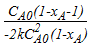 =
= 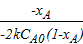 ;
;
При СА0 =const, СB0= СА0∙4;
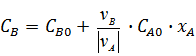 =
= 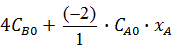 ;
;
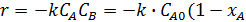 )(4
)(4 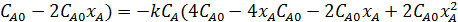 );
);
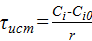 =
= 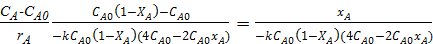 =;
=;
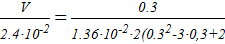 ;
;
VРИС=2,35 м3;
Определяем объем для РИВ:
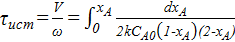 ;
;
VРИВ=2.43 м3
По номограмме 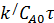 =0,64, M=2.
=0,64, M=2.
Пример 11. Рассчитать k реакции окисления SO2 на оксиде железа при 680 0С,
если скорость реакции окисления описывается уравнением
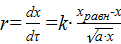 ,
,
где а − процентное содержание SO2,
хравн –равновесная степень превращения,
х – степень превращения в любой момент времени.
хравн 680С = 0,58, известно, что газ содержит 7 % SO2.
Экспериментальные данные:
| τ, сек | 0.02 | 0.06 | 0.1 | 0.19 |
| хдоп | 0.1 | 0.22 | 0.3 | 0.38 |
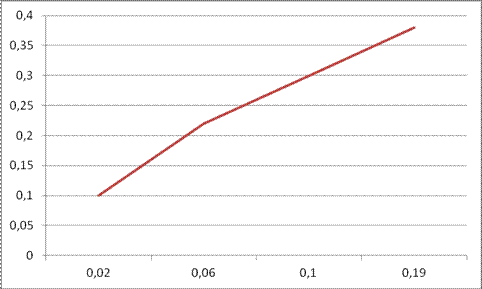
tg1α = 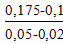 = 2,5;
= 2,5;
tg2α = 1,8;
tg3α = 0,6;
r = 2,5∙ 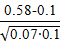 = 7,25;
= 7,25;
Вывод: константы получились разные, значит уравнение неверное.
По найденным r = 7,25, скорости реакции при 680 0 С, найти k при 650 0 С, если Еа =184 кДж∙моль.
Решение. По уравнению Аррениуса 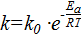 ;
;
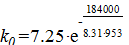 = 22.8;
= 22.8;
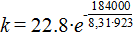 = 7.18.
= 7.18.
Пример 12. Определить k взаимодействия N2 c O2 c образованием NO при Т =2000K, по следующим экспериментальным данным:
| τ, сек | 0,035 | 0,12 | 0,25 | 0,425 | 0,61 |
| х | 0,2 | 0,35 | 0,5 | 0,64 | 0,7 |
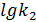 =
= 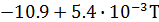 ;
;
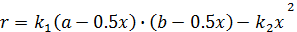 ;
;
x - процентное содержание по объему NO во время τ;
а - начальная концентрация N2 ; a=79
b -начальная концентрация O2; b=21
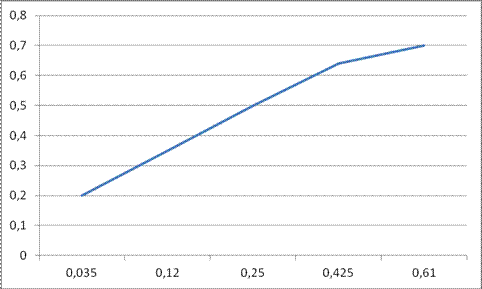
tg1α = 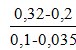 = 1,85;
= 1,85;
t g2α =1,25;
tg3α = 0,8;
tg4α = 0,53;
tg5α = 0,34;
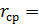 0,954;
0,954;
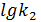 =
= 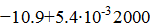 ;
;  0,793
0,793
k1 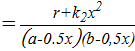 =
= 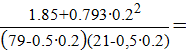 3,48∙10-2;
3,48∙10-2;
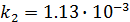 ;
;
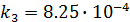 ;
;
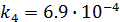 ;
;
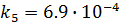 .
.
Дата добавления: 2015-08-17; просмотров: 76 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Решение. | | | УДЕЛЬНАЯ ПРОИЗВОДИТЕЛЬНОСТЬ ПРИ РАСЧЕТЕ РЕАКТОРОВ |