
Читайте также:
|
1. Реакция
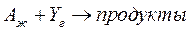
проводится в гетерофазной водно-органической системе в кинетической области. Исследование процесса показало, что при разных соотношениях фаз α наблюдаемая константа скорости меняется. Получены следующие результаты:
| α | 0,2 | 0,4 | 0,6 | 0,8 |
| k набл, м3/(кмоль·с) | 0,202 | 0,295 | 0,402 | 0,495 |
Определить эффективные константы скоростей для каждой фазы. Найти константы скоростей для гомогенных условий, если коэффициенты растворимости равны 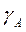 =0,02 и
=0,02 и 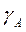 =20.
=20.
2. Гетерофазный процесс
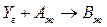
протекает в барботажной колонне при следующих условиях: концентрация реагента А на входе в реактор С А,0 = 5 кмоль/м3; давление газа на входе в колонну Р 0 = 0,15 МПа; объемная концентрация реагента Y на входе – 50%; скорость подачи газа – 0,1 м3/с; скорость подачи жидкости – 0,01 м3/c; температура в колонне – 40 0С; реакционный объем – 2 м3; доля жидкости в единице реакционного объема l = 0,8. Скорость гетерофазного процесса подчиняется уравнению 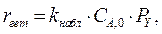 где
где 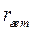 - скорость процесса, отнесенная к единице реакционного объема; k набл = 0,00000025 (Па
- скорость процесса, отнесенная к единице реакционного объема; k набл = 0,00000025 (Па  с)-1. Гидродинамический режим в колонне – идеального смешения, как по газовой, так и по жидкой фазе.
с)-1. Гидродинамический режим в колонне – идеального смешения, как по газовой, так и по жидкой фазе.
Исследование кинетики этой же реакции в жидкой фазе показало, что скорость реакции подчиняется уравнению 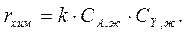
Определить значения констант скорости в каждой фазе.
3. Разложение паров пропионового альдегида при нагревании в кварцевом сосуде протекает как гомогенная реакция первого порядка по уравнению 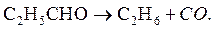
Показать, что реакция является реакцией первого порядка, вычислить среднее значение константы скорости и определить время разложения паров альдегида на 75%. При температуре 576 0С и начальном давлении 314 мм. рт. ст. манометр показывал следующие приращения общего давления (Δ Р) во времени:
| τ, с | |||||
| Δ Р общ, мм рт. ст. |
4. Реакция термического разложения диоксана протекает в газовой фазе при температуре 504 0С в соответствии с уравнением
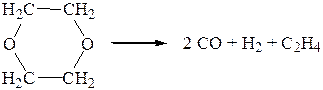
Определить порядок реакции по следующим данным:
| Pn, мм рт. ст. | ||||
| τ1/2, мин. | 13,9 | 15,7 | 19,0 | 25,1 |
| lg P0 | 2,903 | 2,778 | 2,602 | 2,301 |
| lg τ1/2 -1 | 1,143 | 1,196 | 1,278 | 1,414 |
5. Щелочной гидролиз α-бромпропионовой кислоты проводился в водном растворе при 64 0С:
НзССНВгСОО- + ОН- = НзССН(ОН)СОО- + Вг-.
Реакция подчиняется уравнению общего 2-го порядка: первого по каждому из реагентов, начальные концентрации которых составляли
[NaOH]0 = 1,07 М, [НзССНВгСООNа]0 = 0,2 М. За ходом реакции следили по изменению концентрации ионов брома в пробах во времени:
| τ, мин | 1,65 | 3,27 | 6,17 | 10,4 | 15,7 | 19,5 | 31,9 | 55,2 | 69,3 | |
| [Br-], М | 0,012 | 0,020 | 0,040 | 0,062 | 0,083 | 0,098 | 0,133 | 0,168 | 0,180 |
Подтвердите 2-ой порядок и рассчитайте среднюю константу скорости.
6. Распад яблочной кислоты в концентрированной серной кислоте протекает при 40 0С по следующему уравнению
НООССН(ОН)СН2СООН = НООС-СН2СНО + СО + H2O.
3а кинетикой реакции следили по объему выделившегося газа через равные интервалы времени:
| τ, мин | |||||||
| VCO, мл | 3,1 | 5,5 | 7,5 | 9,2 | 10,5 | 11,6 |
Покажите, что реакция подчиняется уравнению первого порядка, вычислите константу скорости и проверьте правильность определения объема оксида углерода, который выделится при полном разложении реагента, если навеска яблочной кислоты равнялась 0,08 г, а давление паров воды при 400С составляет 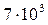 Па = 0,069 атм.
Па = 0,069 атм.
7. В реакции окисления метана СН4 + 2О2 = СО2 + Н2О, протекающей с постоянной скоростью, в течение 5 мин. в сосуде объемом 0.5 л при 5000С образуется 5  10-4 моль воды. Рассчитайте скорость реакции в Па/мин.
10-4 моль воды. Рассчитайте скорость реакции в Па/мин.
8. Превращение пероксида бензоила в дифениловый эфир
(C6H5COO)2 = C6H5COOC6H5 + CO2
(реакция первого порядка) при температуре 600C прошла за 10 мин на 75%. Вычислить константу скорости реакции.
9. Газообразный азометан разлагается по реакции первого порядка
H3CN2CH3 → C2H6 + N2.
Начальное давление чистого азометана при 2870С составляло 160 мм рт. ст. Если общее давление через 100 с достигло 161,6 мм рт. ст., то какая часть азометана при этом разложилась? Какова константа скорости этой реакции? Какое время потребуется для того, чтобы половина азометана разложилась при той же температуре, если начальное давление было 80 мм рт. ст.?
10. Нитрование n-нитротолуола (пнт) азотной кислотой в серной кислоте
НзСС6Н4NО2 + НNО3 = Н3СС6Н4 (NО2)2 + Н2О
идёт как реакция псевдопервого порядка, если азотная кислота взята в избытке (С HNO3 = 0,546). Реакцию проводили при температуре 25 0С в 74,5% H2SО4. Концентрация n-нитротолуола изменялась следующим образом:
| τ, мин. | |||||||||
| С акт·104, моль/л | 3,0 | 2,837 | 2,684 | 2,538 | 2,401 | 2,271 | 2,148 | 2,031 | 1,921 |
Определите графически константу скорости реакции и время полупревращения.
11. Метилацетат подвергся гидролизу в ~ 1 N раствора НСl (CHl = const) при 250C:
СН3СO2СН3 + Н2О = СН3СООН + СН3ОН
Через определенные интервалы из раствора отбираются пробы одинакового объема и титруются раствором NaOH. Покажите, что реакция подчиняется первому порядку, и рассчитайте константу скорости на основании следующих данных:
| τ, с | 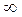
| ||||
| V NaOH, мл | 26,34 | 27,80 | 29,70 | 3,81 | 39,81 |
(Составьте материальный баланс и учтите, что титруются соляная и уксусная кислота).
12. В таблице приведены данные по кинетике разложения гексафенилэтана (А):
(С6Н5)3С-С(С6Н5)3 → 2(С6Н5)3С
при 0 0С в смеси толуола и анилина.
| [A], моль/л | 0,1000 | 0,0867 | 0,0733 | 0,6000 | 0,0465 | 0,0334 |
| τ, мин | 1,05 | 2,20 | 3,65 | 5,5 | 7,85 |
Графическим методом подтвердите первый порядок реакции и определите среднее значение константы скорости при 0 0С.
13. Термическая диссоциация окиси этилена протекает по уравнению
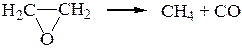
При 687,70С и V = const общее давление реакционной смеси, измеренное в мм рт. ст., изменяется со временем следующим образом:
| τ, мин | ||||||
| Р общ, мм рт. ст. | 116,51 | 120,56 | 125,72 | 128,74 | 133,23 | 141,37 |
Вычислите константу скорости реакции первого порядка.
14. За кинетикой декарбоксилирования гидробензойной кислоты
С6Н7СООН → С6Н8 +СО2
следили по количеству выделившегося диоксида углерода за равные интервалы времени:
| τ, с | |||||||
| V, см3 | 5,9 | 10,0 | 14,0 | 17,2 | 19,8 | 21,9 | 23,7 |
Определите общий объем выделившегося оксида углерода и константу скорости l-го порядка.
15. Реакция между пропионовым альдегидом и синильной кислотой
C2H5CHO + HCN = С2Н5СН(ОН)СN + HCN
в водном растворе является реакцией общего второго порядка. При 250С были получены следующие данные:
| τ, мин | 2,78 | 5,33 | 8,17 | 15,23 | 19,80 |
| [HCN], моль/л | 0,0990 | 0,0906 | 0,0830 | 0,0706 | 0,0653 |
| [C3H7CHO], моль/л | 0,0566 | 0,0482 | 0,0406 | 0,0282 | 0,0229 |
Рассчитайте константу скорости реакции.
16. В результате реакции формальдегида с пероксидом водорода образуется муравьиная кислота. Реакция общего второго порядка.
НСНО + H2О2 = НСООН + Н2О
Если смешать равные объемы молярных растворов НСНО и Н2О2, то через 2 часа при Т = 333,2 К концентрация муравьиной кислоты становится равной 0,215 моль/л. Вычислите константу скорости реакции и определите, через сколько времени прореагирует 98% исходных веществ.
17. Константа скорости реакции омыления этилового эфира уксусной кислоты гидроксидом натрия при 28З 0К равна 2,28 л/моль мин.
Вычислить сколько времени потребуется на омыление 50% этилацетата, если при этой же температуре смешать 1 л 0,05 N раствора этилацетата с 1 л 0,05 N раствора NaOH.
18. Константа скорости реакции омыления этилового эфира уксусной кислоты гидроксидом натрия при 28З 0К равна 2,28 л/моль мин.
Вычислить сколько времени потребуется на омыление 50% этилацетата, если при этой же температуре смешать 1 л 0,05 N раствора этилацетата с 1 л 0,1 N раствора NaOH.
19. Константа скорости реакции омыления этилового эфира уксусной кислоты гидроксидом натрия при 28З 0К равна 2,28 л/моль мин.
Вычислить сколько времени потребуется на омыление 50% этилацетата, если при этой же температуре смешать 1 л 0,05 N раствора этилацетата с 2 л 0,1 N раствора NaOH.
20. Константа скорости реакции:
СН3СООС2Н5 + NaOH → СН3СООNа + C2H5OH
равна 5,4 л/моль мин. Сколько процентов эфира прореагирует за 10 мин, если исходные концентрации щелочи и эфира одинаковы и равны 0,02 моль/л?
21. Константа скорости общего второго порядка для щелочного гидролиза этилформиата при 29,860С равна 4,53 л/моль·с. Каково время полупревращения, если оба реагента имеют одинаковую концентрацию 0,001 моль/л. Если концентрацию одного из реагентов удвоить, а другого уменьшить в два раза, то через какое время прореагирует половина вещества с меньшей концентрацией?
22. Скорость окисления бутилового спирта хлорноватистой кислотой
С4Н9ОН + НСlO → С3Н7СНО + НСI + Н2О
не зависит от концентрации окисляемого вещества и пропорциональна концентрации HCIO во второй степени. Запишите кинетическое уравнение реакции и вычислите время, в течение которого прореагирует 90% НСlO в растворе, содержащем 0,1 моль/л НСlO при 298,2 К. Константа скорости реакции при этой температуре равна 24 л/(моль·мин).
23. Реакция окисления π-аллилпалладихлордида n -бензохиноном в водных кислых растворах протекает при 25 0С и описывается следующим стехиометрическим уравнением:
π-С3Н5РdСl·Н2О + С6Н4О2 + 2НСI → С3Н5Сl + С6Н4(ОН)2 + PdCl2
Начальные концентрации комплекса и соляной кислоты составляли 0,001 и 0,1000 моль/л соответственно. Начальная концентрация n -бензохинона изменялась в опытах от 0,01 до 0,06 моль/л. За кинетикой реакции следили по накоплению в реакционном растворе окрашенного конечного продукта PdCl2 и по этим данным рассчитывали константу скорости реакции 1-го порядка по комплексу. Экспериментальные данные, передающие зависимость константы скорости первого порядка от концентрации n- бензохинона приведены в следующей таблице:
| C БЗХ·102, моль/л | 1,0 | 2,0 | 3,0 | 4,0 | 5,0 | 6,0 |
| k 1·104, сек-1 | 1,523 | 3,046 | 4,569 | 6,092 | 7,615 | 9,138 |
Определите порядок реакции по n-бензохинону и рассчитайте значение константы скорости реакции соответствующего порядка.
24. Нитрование n-нитротолуола (пнт) азотной кислотой в водных растворах серной кислоты (в избытке) протекает по уравнению:
Н3СС6Н4NО2 + НNО3 → Н3СС6Н3(NО2)2 + H2O
При изучении зависимости начальной скорости реакции от концентрации реагентов были получены следующие данные:
| С ПНТ·104, моль/л | ||||
| С HNO3, моль/л | 0,4 | 0,8 | 0,4 | 0,8 |
| r ·104, моль/(л·мин) |
Определите порядок реакции по каждому реагенту и рассчитайте константу скорости реакции.
25. Термическое разложение диоксана изучалось при температуре 5040С. Получена следующая зависимость начальной скорости реакции от давления диоксана в начале реакции:
| r0, мм рт. ст./мин | 42,5 | 14,7 |
| Р0, мм рт. ст. |
Определить порядок и константу скорости реакции.
26. Изучалась зависимость скорости реакции димеризации бутадиена в газовой фазе от начальной концентрации бутадиена.
2С4Н6 → C8H12
При 2400С получены следующие данные:
| С 0, моль/л | 0,05 | 0,1 | 0,15 | 0,20 |
| r 0·104, моль/(л·мин) | 0,565 | 2,26 | 5,07 | 9,02 |
Определите порядок реакции и рассчитайте время полупревращения бутадиена при начальной концентрации его, равной 0,25 моль/л.
27. Реакция йодирования ацетона в растворе соляной кислоты идёт по уравнению:
СН3СОСН3 + I2 + H2O → СН3СОСН2I + H2O+ + I-
Изучалась зависимость скорости реакции от концентрации компонентов системы при 25 0С.
| C ац·102, моль/л | ||||
| C йода·103, моль/л | 1,3 | 1,3 | ||
| С HCl, моль/л | 0,1 | 0,1 | 0,025 | 0,1 |
| r 0·106, моль/(л·мин) | 4,01 | 3,98 | 0,98 |
По приведенным данным выведите кинетическое уравнение реакции и рассчитайте константу скорости реакции.
28. Для реакции разложения ацетальдегида в газовой фазе:
Н3ССНО → СН4 + СО
изучена зависимость начальной скорости от давления ацетальдегида
| Р альд·10-4, Па | 0,88 | 1,08 | 1,6 | 2,93 | 3,49 | 5,05 |
| r 0, Па/мин |
Определите порядок реакции и константу скорости.
29. Реакция термического разложения этана, протекающего при 6000С
С2Н6 = С2Н4+ H2
была получена следующая зависимость концентрации этана от времени
| τ, мин | ||||||
| С, моль/л | 0,24 | 0,21 | 0,19 | 0,17 | 0,15 | 0,14 |
Методом Вант-Гоффа определите порядок реакции и рассчитайте значение константы скорости реакции.
30. Фенилдиазохлорид разлагается по уравнению:
C6H5N2Cl → C6H5CI + N2
В опыте, проводившемся при 323 К, измеряли объемы выделившегося азота. Были получены следующие результаты:
| τ, мин | 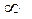
| |||||||||
| V N2, см3 | 19,3 | 26,0 | 32,6 | 36,0 | 41,3 | 45,0 | 46,5 | 48,3 | 50,4 | 58,3 |
Определите порядок реакции и константу скорости реакции.
31. Кинетика реакции димеризации бутадиена
2С4Н6 = C8H12
в газовой фазе изучалась путем измерения общего давления Р во время реакции. Были получены следующие данные при 3260С:
| τ, мин | 3,25 | 8,02 | 12,18 | 17,30 | 24,55 | 33,0 | |
| Р общ, мм рт. ст. | 632,0 | 618,5 | 599,4 | 584,2 | 566,1 | 546,8 | 527,8 |
| τ, мин | 42,50 | 55,08 | 68,05 | 90,05 | 119,00 | 176,67 | 259,50 |
| Р общ, мм рт. ст. | 508,8 | 490,2 | 474,6 | 453,3 | 432,8 | 405,3 | 381,0 |
Определите порядок реакции и константу скорости реакции при данной температуре.
32. Ди- mреm -бутилпероксид распадается по уравнению
(СН3)3СООС(СН3)3 → 2(СН3)2С=О + С2Н6
при 154,90С. Составьте материальный баланс по каждому компоненту, определите порядок реакции и время полураспада из следующих данных по изменению общего давления в системе:
| τ, мин | ||||||||
| Р, мм рт. ст. | 169,3 | 188,3 | 189,2 | 201,1 | 207,1 | 218,7 | 224,4 | 235,6 |
| τ, мин | - | |||||||
| Р, мм рт. ст. | 240,2 | 250,3 | 255,2 | 264,5 | 269,7 | 277,8 | 284,6 | - |
33. Реакция нитрования n-нитротолуола азотной кислотой в водном растворе серной кислоты протекает по уравнению:
n-NО2-С6Н4(СН3) + НNО3 = 2,4-(NО2)2С6Н3(СН3) + Н2О
Реакция проводилась при температуре 250С в 94% H2SО4 и при равных начальных концентрациях реагентов. Время полупревращения изменялось при изменении начальной концентрации n-нитротолуола следующим образом:
| С 0·105, моль/л | 7,22 | 5,37 | 2,8 |
| τ1/2, мин | 14,5 | 19,4 | 37,5 |
Определите порядок реакции и константу скорости реакции.
34. Определите порядок реакции пиролиза диметиловогo эфира при 5040С
СH3СОСН3(газ) = С2Н4 + H2 + СО
по изменению общего давления в ходе реакции. Найдите среднее значение константы скорости реакции (V = const).
| τ, с | 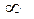
| ||||||
| Р, мм рт. ст. |
35. Графически методом подбора подтвердите, что реакция:
(СН3)3СОО(СН3)3(газ) = 2СН3СОСН3 + С2Н6
идет по первому порядку. Определите по графику константу скорости реакции при 147,20С. За кинетикой реакции следили по изменению общего давления в системе. Были получены следующие данные:
| τ, мин | |||||||
| Р, мм рт. ст. | 179,5 | 187,4 | 198,6 | 210,5 | 221,2 | 231,9 | 242,3 |
| τ, мин | - | ||||||
| Р, мм рт. ст. | 252,5 | 262,1 | 271,3 | 280,2 | 288,9 | 297,1 | - |
36. Гидратация оксида этилена в кислом водном растворе происходит согласно уравнению:
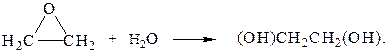
За скоростью реакции следили по изменению объема жидкой системы (пропорционального высоте поднятия уровня жидкости в капиллярной трубке h). Были получены следующие данные при 200С при использовании 0,12 М оксида этилена и 0,00754 М НСlO4
| τ, мин | 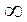
| ||||||||
| h, мм | 18,18 | 18,0 | 17,62 | 17,25 | 16,89 | 15,70 | 15,22 | 14,62 | 12,30 |
Подтвердите первый порядок реакции относительно оксида этилена. Какова константа скорости реакции при 200C?
37. Графически методом подбора определите порядок реакции гидролиза третичного бутилбромида, если при изучении реакции:
(СН3)3СВr + Н2О = (СН3)3СОН + HBr
в растворе (10% воды и 90% ацетона) при 500С были получены следующие данные:
| τ, мин | ||||||||||
| [(CH3)3Br]·102, М | 9,6 | 8,5 | 7,6 | 6,4 | 5,3 | 4,3 | 2,7 | 1,7 | 0,8 |
Рассчитайте константу скорости реакции и время полупревращения.
38. При нагревании 1,2-дихлорпропан отщепляет хлористый водород, давая смесь изомерных хлорпропенов (Т = 500ºС)
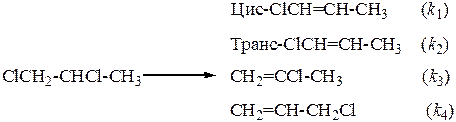
За 2,55 мин разложилось 30% реагента, в этот момент концентрации продуктов составляли 0,035; 0,0175; 0,0017 и 0,096 моль/л соответственно.
Найдите константы скорости образования всех изомеров и начальную концентрацию реагента.
39. Вещество А превращается в продукты X и Y в параллельных реакциях первого порядка, константы скорости которых описываются уравнением Аррениуса со следующими параметрами:
| А, с-1 | Е, кДж/моль | |
| k X | 1015 | |
| k Y | 1011 |
где А – предэкспоненциальный множитель.
Определите, каковы будут концентрации продуктов через 2 часа после начала реакции, если начальная концентрация реагента равна 1 моль/л, и реакция протекает при температуре 300 К.
40. В системе протекают 2 параллельные реакции в газовой фазе
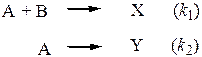
Исходная смесь, содержащая одинаковые количества реагентов, имеет давление 200 торр. В конце реакции, когда реагент А практически полностью израсходован парциальное давление Х составило 10 торр. Найдите отношение констант скоростей этих двух реакций. (Составьте уравнения материального баланса, запишите дифференциальные кинетические уравнения по продуктам, возьмите их отношение и проинтегрируйте после разделения переменных.)
41. Бициклический терпен α-пинен изомеризуется последовательно сначала в моноциклический лимонен(Х) и затем в алифатический аллооцимен (Y) по реакции 1-ого порядка со следующими параметрами уравнения Аррениуса:
| А, с-1 | Е, кДж/моль | |
| k X | 5,25·1014 | |
| k Y | 6,3·1013 |
Определите максимальную концентрацию лимонена (Х) и время ее достижения, если начальная концентрация реагента равна 1 моль/л, и реакция протекает при температуре 250°С. Какова будет концентрация аллооцимена в этот момент?
42. Для реакции гомогенного пиролиза этана, протекающей по следующему основному маршруту
C2H6 → C2H4 + H2.
предложен следующий механизм:
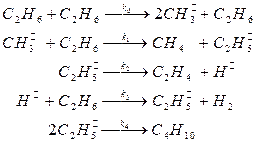
Выведите кинетическое уравнение образования этилена, используя метод квазистационарных концентраций. Каков порядок реакции по реагенту в этом уравнении? Тормозится ли реакция продуктами? Есть ли в механизме лимитирующая стадия?
43. В реакторе идеального смешения происходят следующие реакции:
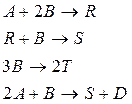
где D – целевой продукт реакции. Начальные концентрации продуктов 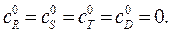 Начальная концентрация исходного вещества А:
Начальная концентрация исходного вещества А: 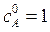 кмоль/м3. Текущие концентрации веществ:
кмоль/м3. Текущие концентрации веществ: 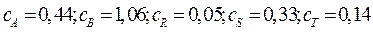 кмоль/м3. Объемный поток:
кмоль/м3. Объемный поток: 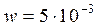 м3/c. Определить производительность реактора по веществу В и по веществу D.
м3/c. Определить производительность реактора по веществу В и по веществу D.
44. Установка состоит из следующих последовательно соединенных реакторов: идеального смешения (V 1 = 2м3), идеального вытеснения (V 1 = 2м3) и идеального смешения (V 1 = 3м3). В реакторах протекает реакция первого порядка А→2В. Начальная концентрация вещества 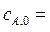 1 кмоль/м3, объемный поток
1 кмоль/м3, объемный поток 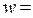 5·10-2 м3/с. Константа скорости реакции k = 8,4·10-3с-1. В начальный момент времени продукт в системе отсутствует, плотность реакционной смеси в ходе реакции не меняется.
5·10-2 м3/с. Константа скорости реакции k = 8,4·10-3с-1. В начальный момент времени продукт в системе отсутствует, плотность реакционной смеси в ходе реакции не меняется.
Определить концентрацию исходного вещества после каждого реактора и рассчитать производительность установки по продукту.
45. В реакторе периодического действия протекает жидкофазная реакция второго порядка A + 2B→ продукты. Плотность реакционной среды в ходе реакции не меняется. Константа скорости реакции рассчитывается по веществу А. Соотношение начальных концентраций веществ 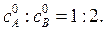 Известно, что за время t = 50 с степень превращения достигает 12 % по веществу А. Вычислить степень превращения вещества А в реакторе идеального вытеснения и в реакторе идеального смешения при том же соотношении исходных веществ, если скорость подачи исходной смеси составляет
Известно, что за время t = 50 с степень превращения достигает 12 % по веществу А. Вычислить степень превращения вещества А в реакторе идеального вытеснения и в реакторе идеального смешения при том же соотношении исходных веществ, если скорость подачи исходной смеси составляет 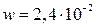 м3/с, а объем каждого реактора V = 5,6м3.
м3/с, а объем каждого реактора V = 5,6м3.
46. Реакция
A + B→2C
проводится в двух реакторах идеального смешения, соединенных последовательно. Объемы реакторов: V 1= 0,2 м3 и V 2= 0,6 м3. Концентрации веществ в потоках, подающихся в первый реактор, равны: 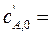 0,24кмоль/м3,
0,24кмоль/м3, 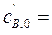 0,36 кмоль/м3.
0,36 кмоль/м3.
Подача исходных веществ осуществляется раздельно со скоростями 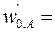 8·10-4м3/с,
8·10-4м3/с, 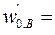 4·10-4м3/с. При t = 0 с С,0 = 0. Плотность реакционной смеси не меняется. Константа скорости реакции k = 4,1·10-2 с–1кмоль–1м3.
4·10-4м3/с. При t = 0 с С,0 = 0. Плотность реакционной смеси не меняется. Константа скорости реакции k = 4,1·10-2 с–1кмоль–1м3.
Определить производительность системы по продукту.
47. Реакция
A + B → 2C
проводится в реакторе идеального смешения объемом 0,8 м3. Подача исходных веществ в реактор осуществляется со скоростями: 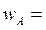 8·10-4 м3/с и
8·10-4 м3/с и 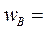 4·10-4 м3/с. Концентрации веществ в потоке равны:
4·10-4 м3/с. Концентрации веществ в потоке равны: 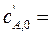 0,24кмоль/м3,
0,24кмоль/м3, 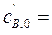 0,36 кмоль/м3 и с С,0 = 0. Константа скорости реакции k = 4,1·10-2 с–1кмоль–1м3. Определить производительность системы по продукту.
0,36 кмоль/м3 и с С,0 = 0. Константа скорости реакции k = 4,1·10-2 с–1кмоль–1м3. Определить производительность системы по продукту.
48. Реакция термического распада этилацетата (А) в газовой фазе при 650К сопровождается образованием уксусной кислоты (В) и этилена:
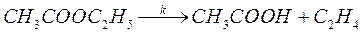
При проведении реакции в реакторе идеального смешения объемом V =330 мл и при скорости подачи газовой смеси w = 4,5 мл/с в системе устанавливается стационарная концентрация уксусной кислоты, равная 2,85% от исходной концентрации этилацетата. Реакция проводится в большом избытке азота, так что изменением объема при протекании реакции можно пренебречь. Определите константу скорости реакции.
49. Определите объем реактора идеального вытеснения, в котором должна происходить реакция
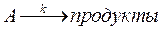
если степень превращения вещества равна 0,2. Константа скорости этой реакции 0,005 с–1, а объемная скорость подачи исходного вещества w = 0,02м3/с.
50. При 20°С и p = 1,013 · 104 Па через реактор идеального смешения V = 5см3 прокачивается поток гелия, содержащий диазометан СН2N2 в концентрации 10–4 моль/дм3. Под действием УФ-облучения СН2N2 разлагается на N2 и С2Н4. При объемной скорости потока 0,125 дм3/с степень превращения диазометана равна 0,4.
Определите константу скорости данной реакции и рассчитайте, через какое время после начала облучения установится стационарная концентрация диазометана?
51. Раствор этилацетата с концентрацией 1,21·10-2кмоль/м3 и раствор едкого натра с концентрацией 4,62 ·10-2 кмоль/м3 подают со скоростью 3,12·10-3 и 3,14 ·10-3 кмоль/с в непрерывно действующий реактор идеального смешения. Объем жидкости в реакторе поддерживается равным 6 м3. Реакция является реакцией первого порядка, k = 0,11 м3/(кмоль·с). Рассчитайте концентрацию этилацетата в растворе на выходе из реактора при стационарном режиме и степень ее превращения.
52. В реакторе идеального смешения протекают параллельные реакции
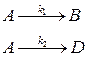
k1 = 0,6 · 10–2, k2 = 1 · 10–2с–1. Определите концентрацию вещества А на выходе из реактора и производительность реактора по веществу А, если объем реактора равен 1 м3, а с А,0 = 2 кмоль/м3.
53. В изотермическом реакторе идеального вытеснения протекает жидкофазная реакция первого порядка
A → B
Константа скорости реакции 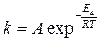 с–1. E a = 108500Дж/моль, Т = 344К; A = 1013 с–1. Начальные концентрации веществ в кмоль/м3: с А,0 = 4,5; с В,0 = 0.
с–1. E a = 108500Дж/моль, Т = 344К; A = 1013 с–1. Начальные концентрации веществ в кмоль/м3: с А,0 = 4,5; с В,0 = 0.
Определите производительность реактора по продукту В, если объемный расход w 0 = 1·10-3 м3 /с, а объем реактора V = 5 м3.
54. Рассчитайте среднее время пребывания реагентов в проточном реакторе идеального смешения, необходимое для достижения степени превращения исходного вещества α = 0,8. В реакторе при Т = const протекает реакция 2A→R + S, константа скорости которой k = 2,5·10-2 м3/(кмоль с). Начальная концентрация реагента А на входе в реактор с А,0 = 4 кмоль/м3.
55. Определите среднее время пребывания реагентов в проточном реакторе идеального вытеснения, необходимое для достижения степени превращения исходного вещества α = 0,8. В реакторе при Т = const протекает реакция 2A→R + S, константа скорости которой k = 2,5·10-2 м3/(кмоль с). Начальная концентрация реагента А на входе в реактор с А,0 = 4 кмоль/м3.
56. Для параллельной реакции
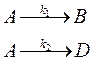
где k 1 = 4,6·10-4 и k 2 = 1,1·10-4 с–1, найдите степень превращения вещества А за время t = 5000 с для реактора идеального смешения и реактора идеального вытеснения.
57. Реакция 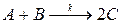 проводится в двух реакторах идеального вытеснения, соединенных последовательно. Объемы реакторов: V 1 = 0,2, V 2 = 0,6 м3. Концентрации исходных веществ на входе в первый реактор равны: c A,0 = 0,16, c B,0 = 0,12 кмоль/м3. Скорость подачи исходных веществ равна: w = 1,2 · 10–3 м3/с, c C,0 = 0, k = 4,1 · 10–2 кмоль–1с–1м3. Определите производительность системы по продукту.
проводится в двух реакторах идеального вытеснения, соединенных последовательно. Объемы реакторов: V 1 = 0,2, V 2 = 0,6 м3. Концентрации исходных веществ на входе в первый реактор равны: c A,0 = 0,16, c B,0 = 0,12 кмоль/м3. Скорость подачи исходных веществ равна: w = 1,2 · 10–3 м3/с, c C,0 = 0, k = 4,1 · 10–2 кмоль–1с–1м3. Определите производительность системы по продукту.
58. Рассчитайте степень превращения исходного вещества при протекании реакции 2A → продукты в реакторе идеального вытеснения объемом 1 м3. Начальная концентрация c А,0 = 2кмоль/м3, k = 2,5 · 10–2 с–1, а скорость подачи w = 2 · 10–2 м3/с.
59. Установлено, что реакция омыления эфира
СH3COOCH3 + NaOH → CH3COONa + CH3OH
имеет второй порядок, и для одинаковых исходных концентраций реагентов (С 0 = 10-2 М) через 10 мин прореагировало 20% эфира.
Определите сколько времени необходимо, чтобы подвергнуть омылению 50% эфира.
60. Установлено, что реакция омыления эфира
СH3COOCH3 + NaOH → CH3COONa + CH3OH
имеет второй порядок, и для одинаковых исходных концентраций реагентов (С0 = 10-2 М) через 10 мин прореагировало 20% эфира.
Вычислите концентрацию спирта СН3ОН, полученного через 30 мин протекания реакции.
61. Определите константу скорости реакции при температуре 273 К, энергия активации которой равна 160 кДж·моль-1. С какой допустимой погрешностью следует осуществить измерение температуры, чтобы получить значение константы скорости с точностью до 2%?
62. При окислении параксилола кислородом (кислород взят в большом избытке) образуется паратолуиловый альдегид по реакции
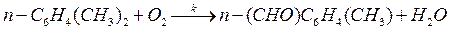
Экспериментально были получены следующие значения опытной константы скорости при разных температурах: k 1 = 0,114 мин–1 (Т 1 = 433 К); k 2 = 0,215 мин–1 (Т 2 = 453 К); k 3 = 0,383 мин–1 (Т 3 = 473 К); k 4 = 0,653 мин–1 (Т 4= 493 К). Вычислите энергию активации для данной реакции.
63. Константа скорости окисления метанола диметилдиоксираном при 25°С равна 2,4 · 10–4 дм3/(моль·с). Энергия активации процесса равна 67,4кДж/моль. Рассчитайте значение предэкспоненциального множителя данной реакции и константу скорости при температуре 40 °С.
64. Для некоторой реакции второго порядка с начальной концентрацией 0,8 моль/дм3 при повышении температуры на 20 °C время достижения степени превращения вещества, равное α = 25 %, изменилось с 20 до 5 мин. Рассчитайте значение энергии активации и предэкспоненциального множителя данной реакции.
65. Для реакции диссоциации дициклопентадиена
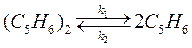
отношение констант скоростей прямой реакции при двух температурах: Т 1 = 170 °C и Т 2 = 180 °C равно 0,416. Вычислите энергию активации прямой и обратной реакций, если изменение внутренней энергии для этого процесса Δ rU ° = –545 кДж/моль.
66. Взаимодействие трет-бутила с масляным альдегидом в среде CCl4 представляет собой обратимую химическую реакцию. Известно, как изменяются константы скоростей прямого и обратного процессов с температурой:
| Т, 0C | |||
| k 1, дм3/(моль·мин) | 0,6 | 0,75 | 93,81 |
| k 2·102, мин-1 | 1,1 | 1,8 | 3,0 |
Вычислите энергию активации прямой и обратной реакций, значения предэкспоненциальных множителей и изменение внутренней энергии этого процесса. Опишите, как изменяется константа равновесия с температурой.
67. При исследовании кинетики взаимодействия диметилбензиламина с иодистым метилом в нитробензоле
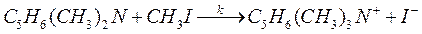
были получены следующие данные:
| Т, К | 273,2 | 283,2 | 293,3 | 303,0 |
| k 1·103, см3/(моль·с) | 0,922 | 1,640 | 2,800 | 4,610 |
Вычислите энергию активации и предэкспоненциальный множитель для данной реакции.
68. Реакция разложения кислоты C10H15OCOOH проводится в среде абсолютного этанола и протекает по двум направлениям с константами скоростей k 1 и k 2:
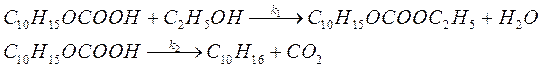
Какова разность энергий активаций этих процессов, если при 298 К отношение констант скоростей k 1/ k 2 = 0,99, а при 338 К — k 1/ k 2 = 2?
69. Реакция разложения вещества А в растворе является реакцией первого порядка. Период полупревращения вещества А при 25 °С равен 104 ч, а при 35 °С равен 39 ч. Определите энергию активации и температурный коэффициент константы скорости. Рассчитайте время, за которое разложится 90 % вещества А при 45 °С.
70. Вещество разлагается двумя параллельными путями с константами скоростей k 1 и k 2. Какова разность энергий активаций этих процессов, если при 10 °С отношение констант скоростей k 1 / k 2 = 10, а при 40 °С k 1 / k 2 = 0,1?
71. Для некоторой реакции первого порядка при температурах 613К, 633К и 653 К константы скорости реакции, соответственно, равны 1,183; 2,251 и 3,956 ч–1. Рассчитайте энергию активации и предэкспоненциальный множитель данного процесса.
72. При изучении реакции
С2Н5I + OH- → C2H5OH + I-
было измерено время полупревращения для различных концентраций реагентов С 0 при температуре 298 К:
| С 0, М | 0,010 | 0,025 | 0,050 | 0,075 | 0,100 |
| t 1/2, мин |
Покажите, что эти результаты отвечают кинетике второго порядка. Найдите значение константы скорости реакции при 298 К.
73. При изучении реакции
С2Н5I + OH- → C2H5OH + I-
было измерено время полупревращения для различных концентраций реагентов С 0 при температуре 298 К:
| С 0, М | 0,010 | 0,025 | 0,050 | 0,075 | 0,100 |
| t 1/2, мин |
Вычислите константу скорости реакции при температуре 600С и определите время полупревращения при этой температуре для начальной концентрации реагентов, равной 0,05 М, если известно значение энергии активации, Е а = 89 кДж·моль-1.
74. Для обратимой реакции первого порядка
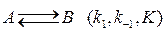
константа равновесия К = 4, а константа скорости прямой реакции k 1 = 0,02 мин-1. Рассчитайте время, за которое концентрация реагента и продукта сравняются, если начальная концентрация компонента В равна нулю.
75. В системе протекают 2 параллельные реакции
А + В → Х (k 1)
A + C → Y (k 2)
Отношение констант скоростей k 1/ k 2 = 4. Начальные концентрации компонентов В и С одинаковы. Сколько продукта Y получится к моменту времени t, когда концентрация Х составит половину начальной концентрации В.
Дата добавления: 2015-08-17; просмотров: 410 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ | | | Решение. |