
Читайте также:
|
Пример 1. Вывести кинетическое уравнение для гетерофазного процесса хлорирования этилена газообразным хлором:

Известно, что кинетика этого процесса в гомогенных условиях (в растворе дихлорэтана) подчиняется следующему кинетическому уравнению:  где
где 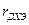 - скорость образования дихлорэтана;
- скорость образования дихлорэтана;  - концентрация этилена, хлора и катализатора в жидкой фазе. Реакция проводится в барботажной колонне при мольном отношении
- концентрация этилена, хлора и катализатора в жидкой фазе. Реакция проводится в барботажной колонне при мольном отношении 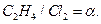 Принять, что этилен и хлор используются в виде чистых газов.
Принять, что этилен и хлор используются в виде чистых газов.
Решение. Примем, что в барботажную колонну подается в виде газов W м3/c хлора и α W м3/c этилена. Суммарный расход газов (1+α) W. При полной конверсии хлора остаточный расход непрореагировавших газов (1-α) W. Коэффициент изменения объема

Текущие концентрации этилена и хлора в жидкой фазе:

где  – давление в колонне.
– давление в колонне.
Кинетическое уравнение для гетерофазного процесса хлорирования этилена газообразным хлором
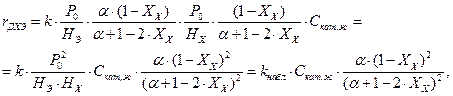
где 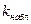 – наблюдаемая константа скорости гетерофазного процесса.
– наблюдаемая константа скорости гетерофазного процесса.
Для частного случая, когда α=1, уравнение имеет вид

т.е. скорость процесса не зависит от степени конверсии; зависит только от концентрации катализатора в жидкой фазе и от общего давления в колонне.
Пример 2. Экспериментальные исследования гетерофазного процесса
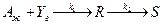
на опытно-промышленном барботажном реакторе с мешалкой были проведены при большом разбавлении реагента Y инертным газо, мольном избытке реагента А над Y более 50 и при постоянном расходе газа. Полеченные результаты свидетельствуют, что гетерофазный процесс протекает в переходной области и значение наблюдаемой константы скорости зависит от начальной концентрации реагента А:
| С А,0 | 2,0 | 3,0 | 4,0 | 5,0 | 6,0 |
| k набл, с-1 | 0,106 | 0,124 | 0,143 | 0,151 | 0,164 |
Определить констату скорости химической реакции k 1, эффективный коэффициент массаотдачи 
Решение. Для гетерофазного процесса, протекающего в переходной области и псевдонулевом порядке реакции по реагенту А, справедливо следующее выражение:

где – наблюдаемая константа скорости,  .
.
Величины  и k 1 можно найти, построив график зависимости
и k 1 можно найти, построив график зависимости  от
от 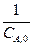 . В таблице 1 представлены исходные расчетные данные для построения этого графика.
. В таблице 1 представлены исходные расчетные данные для построения этого графика.
Таблица – Исходные данные для определения  и k 1
и k 1
| С А,0, кмоль/м3 | k набл, 1/c | 1/ C А,0 | 1/ k набл |
| 2,0 | 0,106 | 0,500 | 9,41 |
| 3,0 | 0,124 | 0,333 | 8,08 |
| 4,0 | 0,143 | 0,250 | 6,97 |
| 5,0 | 0,151 | 0,200 | 6,62 |
| 6,0 | 0,164 | 0,167 | 6,09 |

Рисунок 1 – Графический способ определения  и k 1
и k 1
Отрезок, который отсекается от оси ординат, равен  . Эффективный коэффициент массаотдачи
. Эффективный коэффициент массаотдачи  .
.
Тангенс угла наклона равен 1/ k 1 = 9,895. Константа скорости химической реакции k 1 = 0,1 м3/(кмоль  с).
с).
Пример 3. Гетерогенно-каталитическая реакция А+Y  B протекает в кинетической области и имеет уравнение скорости
B протекает в кинетической области и имеет уравнение скорости

Найдите аналитическое решение для максимума начальной скорости процесса в зависимости от мольного соотношения исходных реагентов, если процесс проводится при постоянном общем давлении Р0 в отсутствии посторонних разбавителей. Проанализируйте полученное уравнение.
Решение. Обозначим мольное соотношение реагента Y к реагенту А в газовой смеси – α. Учитывая, что  , парциальные давления реагентов равны:
, парциальные давления реагентов равны:
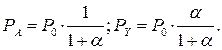
Подставим парциальные давления в выражение скорости процесса, получим

Производная скорости процесса по мольному соотношению реагентов равна


Максимум начальной скорости процесса будет наблюдаться при условии  , т.е. при
, т.е. при 
Таким образом, начальная скорость процесса зависит от общего давления и мольного отношения реагентов α. Причем повышение общего давления прямо пропорционально увеличивает скорость процесса, а зависимость скорости процесса от мольного отношения исходных реагентов имеет максимум.
Дата добавления: 2015-08-17; просмотров: 83 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Расчет константы равновесия в неидеальных газовых системах | | | ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ |