
Читайте также:
|
1. Рассчитать состав равновесной смеси, получающийся при изомеризации этилбензола при 600 К и 1 атм. Возможные параллельные реакции
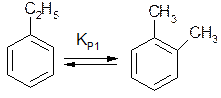

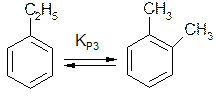
Использовать следующие данные:
| ЭБ | О-ксилол | М-ксилол | П-ксилол | |
| ΔG600, ккал/моль | 57,646 | 55,099 | 56,103 | 56,060 |
2. Рассчитать состав равновесной смеси, получающийся при изомеризации этилбензола при 700 К и 1атм. Возможные параллельные реакции
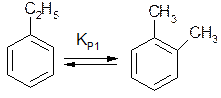

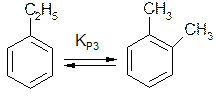
Использовать следующие данные:
| ЭБ | О-ксилол | М-ксилол | П-ксилол | |
| ΔG600, ккал/моль | 57,646 | 56,103 | 55,099 | 56,060 |
3. Рассчитать состав равновесной смеси, получающийся при изомеризации этилбензола при 800 К и 2 атм. Возможные параллельные реакции
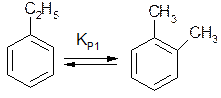

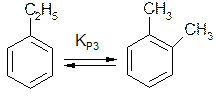
Использовать следующие данные:
| ЭБ | О-ксилол | М-ксилол | П-ксилол | |
| ΔG600, ккал/моль | 57,646 | 55,099 | 56,103 | 56,060 |
4. При алкилировании изобутана 1-бутеном возможны следующие реакции:
I) изо-С4Н10 + изо-С4Н8 ↔ СН3—С(СН3)2—С(СН3)2—СН3
2, 2, 3, 3-тетраметилбутан
II) изо-С4Н10 + изо-С4Н8 ↔ СН3—С(СН3)2—СН2—СН(СН3)—СН3
2, 2, 4-триметилпентан
Рассчитать состав равновесной смеси при 500 К и 10 атм, если исходные вещества взяты в эквимолекулярных количествах. Реакция идет в газовой фазе.
5. В реакторе одновременно протекают реакции алкилирования и полимеризации при 500 К и 1атм
I) С3Н6 + С4Н10 ↔ С7Н16 (2,3-диметилпентан)
II) 2С3Н6↔С6Н12 (1-гексен)
Константы равновесия для первой реакции Кр = 34,5; для второй Кр = 7,19. Каков теоретический выход, если для проведения реакций в одном случае взято по одному молю С3Н6 и С4Н10, в другом — 3 моля С3Н6 и 1 мольС4Н10? Реакция протекает в газовой фазе.
6. В реакторе одновременно протекают реакции алкилирования и полимеризации при 500 К и 1атм
I) С3Н6 + С4Н10 ↔ С7Н16 (2,3-диметилпентан)
II) 2С3Н6↔С6Н12 (1-гексен)
Константы равновесия для первой реакции Кр = 36,5; для второй Кр = 8,17. Каков теоретический выход, если для проведения реакций взято по одному молю С3Н6 и С4Н10? Реакция протекает в газовой фазе.
7. В реакторе одновременно протекают реакции алкилирования и полимеризации при 500 К и 1атм
I) С3Н6 + С4Н10 ↔ С7Н16 (2,3-диметилпентан)
II) 2С3Н6↔С6Н12 (1-гексен)
Константы равновесия для первой реакции Кр = 36,5; для второй Кр = 8,17. Каков теоретический выход, если для проведения реакций взято 2 моля С3Н6 и 1 моль С4Н10? Реакция протекает в газовой фазе.
8. Определить состав равновесной газовой смеси, получающейся в процессе изомеризации этилбензола в ксилолы при 700 К и 1атм, если известны константы равновесия реакций
С2Н5С6Н5↔ о -С6Н4(СН3)2; Кр = 2,68
С2Н5С6Н5↔ п -С6Н4(СН3)2; Кр = 2,58
С2Н5С6Н5↔ м -С6Н4(СН3)2; КР = 5,74
Для реакции взят 1 моль этилбензола.
9. Определить состав равновесной газовой смеси, получающейся в процессе изомеризации этилбензола в ксилолы при 600 К и 1атм, если известны константы равновесия реакций
С2Н5С6Н5↔ о -С6Н4(СН3)2; Кр = 2,68
С2Н5С6Н5↔ п -С6Н4(СН3)2; Кр = 2,58
С2Н5С6Н5↔ м -С6Н4(СН3)2; КР = 5,74
Для реакции взят 2 моль этилбензола.
10. Определить состав равновесной газовой смеси, получающейся в процессе изомеризации этилбензола в ксилолы при 700 К и 0,5атм, если известны константы равновесия реакций
С2Н5С6Н5↔ о -С6Н4(СН3)2; Кр = 2,68
С2Н5С6Н5↔ п -С6Н4(СН3)2; Кр = 2,58
С2Н5С6Н5↔ м -С6Н4(СН3)2; КР = 5,74
Для реакции взят 1 моль этилбензола.
11. Определить состав равновесной газовой смеси, получающейся в процессе изомеризации этилбензола в ксилолы при 800 К и 1атм, если известны константы равновесия реакций
С2Н5С6Н5↔ о -С6Н4(СН3)2; Кр = 2,68
С2Н5С6Н5↔ п -С6Н4(СН3)2; Кр = 2,58
С2Н5С6Н5↔ м -С6Н4(СН3)2; КР = 5,74
Для реакции взят 2 моль этилбензола.
12. Рассчитать выход ароматических углеводородов, получающихся в процессе ароматизации 1моля н -октана при 550 К и 1 атм в газовой фазе
С8Н18↔ п -С6Н4(СН3)2+4Н2; Кр = 1,01
С8Н18↔ м -С6Н4(СН3)2+4Н2; Кр = 2,286
С8Н18↔ о -С6Н4(СН3)2+4Н2; Кр = 0,933
С8Н18↔С6Н5С2Н5+4Н2; Кр = 0,207
13. Определить теоретически возможный выход бутенов при 1000 К и 1 атм в следующих параллельно протекающих реакциях:
СН3(СН2)2СН3↔1-бутен+Н2
СН3(СН2)2СН3↔ цис -2-бутен+Н2
СН3(СН2)2СН3↔ транс- 2-бутен + Н2
СН3(СН2)2СН3↔метил-2-пропен+Н2
В исходной реакционной смеси содержится 1 моль н -бутана.
14. Вычислить состав равновесной смеси для параллельно протекающих газовых реакций
С3Н8↔2H2 + СНССН3
С3Н8↔2Н2+СН2=С=СН2
при 1000 К и 0,5атм. Для реакции взят 1 моль пропана.
15. Определить равновесный состав смеси в результате гидрокрекинга н -додекана при 800 К и 20атм. Исходная газовая смесь эквимолекулярная. Образуются следующие продукты:
С12Н26 + H2↔ 2 н -С6Н14
С12Н26 + H2↔ н -С5Н12 + н -С7Н16
С12Н26 + H2↔ н -С4Н10 + н -С8Н18
Использовать следующие данные:
| Соединение | ΔG800, ккал/моль |
| С12Н26 | 159,7 |
| н -С6Н14 | 73,08 |
| н -С5Н12 | 58,77 |
| н -С7Н16 | 87,45 |
| н -С4Н10 | 44,21 |
| н -С8Н18 | 101,9 |
Считать газы идеальными.
16. Вычислить состав равновесной смеси реакции гидрокрекинга н -тетрадекана C14H30 при 850 К и 10атм.
C14H30 (г) +2Н2↔СН4+С4Н10+ н -С9Н20(г); lgKp = 7,34
C14H30 (г) +2Н2↔С2Н6+ н -С5Н12+ н -С7Н16(г ); lgKp = 6,845
C14H30 (г) +2Н2↔ С2Н6+ н -С4Н10+ н -С8Н18(г); lgKp = 6,875
Для реакции взяты 1 мольтетрадекана и 2 моля водорода.
17. При пиролизе пропана протекают следующие реакции:
С3Н8↔ C3H6 +Н2
С3Н8↔ C2H4 +СН4
Рассчитать состав при равновесии, если реакция проводится при 1000 К и 1атм в газовой фазе.
18. Вычислить состав равновесной смеси газообразной реакции изомеризации 1 моля 1-бутена при 1атмв интервале температур от 400 до 900 К. Изомеризация идет по уравнениям
СН2=СН—СН2—СН3 ↔ СН3—СН=СН—СН3 (цис)
СН2=СН—СН2—СН3 ↔ СН3—СН=СН—СН3 (транс)
СН2=СН—СН2—СН3 ↔ СН2=С(СН3)2
По результатам построить графическую зависимость равновесного состава от температуры.
19. Рассчитать выход ароматических углеводородов, получающихся в процессе ароматизации 1моля н -октана при 700 К и 1 атм в газовой фазе
С8Н18↔ п -С6Н4(СН3)2+4Н2; Кр = 1,01
С8Н18↔ м -С6Н4(СН3)2+4Н2; Кр = 2,286
С8Н18↔ о -С6Н4(СН3)2+4Н2; Кр = 0,933
С8Н18↔С6Н5С2Н5+4Н2; Кр = 0,207
20. Определить равновесный состав смеси в результате гидрокрекинга н -додекана при 700 К и 1атм. Исходная газовая смесь эквимолекулярная. Образуются следующие продукты:
С12Н26 + H2↔ 2 н -С6Н14
С12Н26 + H2↔ н -С5Н12 + н -С7Н16
С12Н26 + H2↔ н -С4Н10 + н -С8Н18
Использовать следующие данные:
| Соединение | ΔG800, ккал/моль |
| С12Н26 | 159,7 |
| н -С6Н14 | 73,08 |
| н -С5Н12 | 58,77 |
| н -С7Н16 | 87,45 |
| н -С4Н10 | 44,21 |
| н -С8Н18 | 101,9 |
Считать газы идеальными.
Дата добавления: 2015-08-17; просмотров: 229 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Расчет константы равновесия в случае простой реакции | | | Расчет константы равновесия при последовательно протекающих реакциях |