
|
Читайте также: |
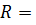 8,31
8,31  = 1,987 кал/К∙моль.
= 1,987 кал/К∙моль.
 υ = 8,983+30,229∙10−3 T +3,722∙10−7 T 2 Дж/ К∙моль,
υ = 8,983+30,229∙10−3 T +3,722∙10−7 T 2 Дж/ К∙моль,
 υ = 8,983+30,229∙10−3(1500−298)+3,722∙10−7(1500−298)2,
υ = 8,983+30,229∙10−3(1500−298)+3,722∙10−7(1500−298)2,
 = 8,983+8,31+30,229∙10−3 T +3,722∙10−7 T 2,
= 8,983+8,31+30,229∙10−3 T +3,722∙10−7 T 2,
 = 17,293+30,229∙10−3 T +3,722∙10−7 T 2,
= 17,293+30,229∙10−3 T +3,722∙10−7 T 2,
 = 17,293 T +30,229∙10−3 T 2+3,722∙10−7 T 3.
= 17,293 T +30,229∙10−3 T 2+3,722∙10−7 T 3.
 = 17,293+60,458∙10−3 T +11,166∙10−7 T 2 =
= 17,293+60,458∙10−3 T +11,166∙10−7 T 2 =  ,
,
 = 17,293+60,458∙10−3∙298+11,166∙10−7 ∙2982 = 35,409 Дж/ К∙моль.
= 17,293+60,458∙10−3∙298+11,166∙10−7 ∙2982 = 35,409 Дж/ К∙моль.
Пример 8. Для реакции:
CO(г)+H2O(г)→CO2(г)+H2(г)
рассчитать энтальпию реации через величины энтальпии разрывающихся и образующихся связей при 298 К и 1 атм. Считать, что  ,
,
Известно, что 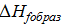 =
= 








 Решение.:С=О + О → С=О +H−H
Решение.:С=О + О → С=О +H−H
H H O
разр образ образ
ΔHp =  .
.
ΔHp = 2∙  +
+ 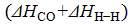 образ = 2∙463+(−532−436) = −42
образ = 2∙463+(−532−436) = −42 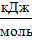 .
.
Пример 9. Рассчитать среднюю H диссоциации химической связи в молекуле метана по уравнению
CH4(г)→С(г) + 4H(г)
−74,85 718,38 217,94
Решение. Используем справочные данные 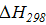 :
:
 = 718,38+4∙217,94−(−74,85) = 1664,99
= 718,38+4∙217,94−(−74,85) = 1664,99 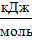 .
.
Теплота пошедшая на разрыв четырех связей:
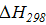 /4 = 416,25
/4 = 416,25 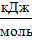 .
.
Пример 10. Зависимость Кр от температуры для реакции:
CO(г)+H2O(г)→CO2(г)+H2(г)
Определяется следующим уравнением:
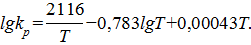 Найти стандартную теплоту реакции при 25 OC, используя:
Найти стандартную теплоту реакции при 25 OC, используя:
1) Закон Гесса;
2) уравнение изобары  .
.
Дата добавления: 2015-08-17; просмотров: 170 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Решение. | | | Решение. |