
|
Читайте также: |
С2H6(жид) → С2H6(газ)
Δ 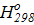 =
= 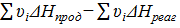 = −56,240−(−66,356) = 10,116,
= −56,240−(−66,356) = 10,116,
Δа =  = 4,946−25,46 = −20,514,
= 4,946−25,46 = −20,514,
Δb = 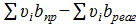 = 49,087∙10−3−(−39,6∙10−3) = 88,687∙10−3,
= 49,087∙10−3−(−39,6∙10−3) = 88,687∙10−3,
Δс = 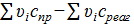 = −23,885−137 = −160,885∙10−6.
= −23,885−137 = −160,885∙10−6.
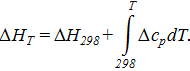
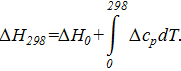
 = −20,514∙298+
= −20,514∙298+  ∙88,687∙10−3+
∙88,687∙10−3+ 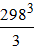 ∙(−160,885∙10−6) = −3594,49.
∙(−160,885∙10−6) = −3594,49.
10,116∙103=  −3594,49
−3594,49
где  =13,710 ккал/моль.
=13,710 ккал/моль.
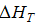 =
=  + ΔаT +
+ ΔаT +  T2 +
T2 +  T3.
T3.
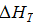 = 13,710+(−20,514T)+44,343∙10−3T2−53,628∙T3∙10−6.
= 13,710+(−20,514T)+44,343∙10−3T2−53,628∙T3∙10−6.
Пример 6. Стандартная теплота реакции:
CH4+CO2→CO+H2,
который протекает в газовой фазе при 900 К равна 260119 Дж. Даны теплоемкости реагентов при различных реагентах.
 Т
ср Т
ср
| ||
| CH4 | 63,18 | 72,0 |
| CO2 | 40,21 | 42,77 |
| CO | 29,81 | 30,36 |
| H2 | 28,96 | 29,15 |
Найти Δ  . Принять что в интервале от 800 до 1000 средняя теплоемкость:
. Принять что в интервале от 800 до 1000 средняя теплоемкость:
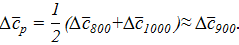 Результаты расчета сравнить с литературной величиной, которая равна
Результаты расчета сравнить с литературной величиной, которая равна  259491 Дж.
259491 Дж.
Дата добавления: 2015-08-17; просмотров: 179 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Решение. | | | Решение. |