
|
Читайте также: |
Δ 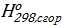 =
= 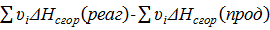 .
.
Δ 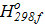 =
= 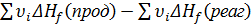 .
.
2C2H6→2CH4+C2H2+H2
Δ 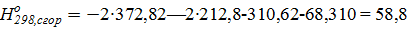 .
.
Δ 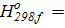 54,194+(−17,889∙2)−(−2∙20,236) = 58,89.
54,194+(−17,889∙2)−(−2∙20,236) = 58,89.
Δ 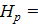 Δ
Δ 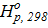 +
+ 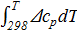 .
.
| C2H6 | CH4 | C2H2 | H2 | |
| a | 1,074 | 4,171 | 5,607 | 6,95 |
| b∙103 | 43,561 | 14,45 | 20,499 | -0,20 |
| c∙106 | -17,891 | 0,267 | -13,944 | 0,48 |
Δ 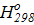 = 58,89 ккал/моль = 58,89∙103 кал/моль.
= 58,89 ккал/моль = 58,89∙103 кал/моль.
Δ 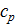 = а+bT+cT2.
= а+bT+cT2.
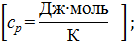
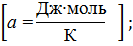
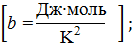

Допустим, что 1 Дж = 1 кал.
Δ 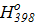 = 58,89∙103+
= 58,89∙103+ 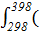 18,751−37,923∙10-3∙398+22,852∙10-6∙3982)dT =
18,751−37,923∙10-3∙398+22,852∙10-6∙3982)dT =
58,89∙103 +18,751(398−298)−37,923∙10-3∙ 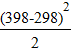 +22,852∙10-6∙
+22,852∙10-6∙ 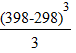 = 60,962 ккал/моль.
= 60,962 ккал/моль.
Δа = 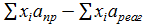 = (2∙4,171+5,607+6,95)−(2∙1,074) = 18,751,
= (2∙4,171+5,607+6,95)−(2∙1,074) = 18,751,
Δb = 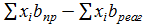 = (2∙1445+20,499−0,20)−(2∙43,561) = −37,923∙10-3,
= (2∙1445+20,499−0,20)−(2∙43,561) = −37,923∙10-3,
Δс = 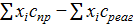 = (0,267∙2−13,944+0,48)−(−17,891)∙2 = 22,852∙10-6.
= (0,267∙2−13,944+0,48)−(−17,891)∙2 = 22,852∙10-6.
Пример 2. Вычислить теплоемкость CH4 при 25 ОС, если при той же температуре и давлений 1 атм 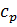 = 8,536 кал/К∙моль, считать что:
= 8,536 кал/К∙моль, считать что:
1)CH4− идеальный газ;
2) CH4− реальный газ.
Дата добавления: 2015-08-17; просмотров: 150 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| ГЛАВА 2. ТЕРМОДИНАМИКА ХИМИЧЕСКИХ РЕАКЦИЙ | | | Решение. |