
Читайте также:
|
1. При совмещенном дегидрохлорировании и хлорировании 1,1,2,2-тетрохлорэтана протекает суммарная реакция:
Cl2-CH-CH-Cl2→Cl-CH=C-Cl2 + HCl
Cl2-CH-CH-Cl2 + Cl2→ Cl2-C=C- Cl2 + 2HCl
Вывести уравнения парциальных давлений веществ и посчитать их с учетом содержания инертных примесей в хлор газе 8 мольных процентов и мольного соотношения реагентов 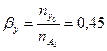 . Известно, что общее давление в системе равно 0,2; степень превращения
. Известно, что общее давление в системе равно 0,2; степень превращения 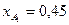 и
и 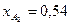 .
.
2. При совмещенном дегидрохлорировании и хлорировании 1,1,2,2-тетрохлорэтана протекает суммарная реакция:
Cl2-CH-CH-Cl2→Cl-CH=C-Cl2 + HCl
Cl2-CH-CH-Cl2 + Cl2→ Cl2-C=C- Cl2 + 2HCl
Вывести уравнения парциальных давлений веществ и посчитать их с учетом содержания инертных примесей в хлор газе 9 мольных процентов и мольного соотношения реагентов  . Известно, что общее давление в системе равно 0,13; степень превращения
. Известно, что общее давление в системе равно 0,13; степень превращения 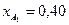 и
и  .
.
3. При совмещенном дегидрохлорировании и хлорировании 1,1,2,2-тетрохлорэтана протекает суммарная реакция:
Cl2-CH-CH-Cl2→Cl-CH=C-Cl2 + HCl
Cl2-CH-CH-Cl2 + Cl2→ Cl2-C=C- Cl2 + 2HCl
Вывести уравнения парциальных давлений веществ и посчитать их с учетом содержания инертных примесей в хлор газе 5 мольных процентов и мольного соотношения реагентов 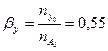 . Известно, что общее давление в системе равно 0,3; степень превращения
. Известно, что общее давление в системе равно 0,3; степень превращения 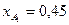 и
и 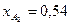 .
.
4. При совмещенном дегидрохлорировании и хлорировании 1,1,2,2-тетрохлорэтана протекает суммарная реакция:
Cl2-CH-CH-Cl2→Cl-CH=C-Cl2 + HCl
Cl2-CH-CH-Cl2 + Cl2→ Cl2-C=C- Cl2 + 2HCl
Вывести уравнения парциальных давлений веществ и посчитать их с учетом содержания инертных примесей в хлор газе 7 мольных процентов и мольного соотношения реагентов 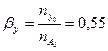 . Известно, что общее давление в системе равно 0,17; степень превращения
. Известно, что общее давление в системе равно 0,17; степень превращения 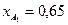 и
и  .
.
5. При совмещенном дегидрохлорировании и хлорировании 1,1,2,2-тетрохлорэтана протекает суммарная реакция:
Cl2-CH-CH-Cl2→Cl-CH=C-Cl2 + HCl
Cl2-CH-CH-Cl2 + Cl2→ Cl2-C=C- Cl2 + 2HCl
Вывести уравнения парциальных давлений веществ и посчитать их с учетом содержания инертных примесей в хлор газе 7 мольных процентов и мольного соотношения реагентов 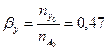 . Известно, что общее давление в системе равно 0,12; степень превращения
. Известно, что общее давление в системе равно 0,12; степень превращения 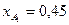 и
и 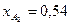 .
.
6. Для реакции 2С5H10↔C10H10
Вывести уравнение парциального давления веществ и посчитать их с учетом содержания 12 мольных процентов инертных примесей и мольного соотношения реагентов 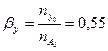 . Известно, что общее давление в системе равно 0,3; степень превращения
. Известно, что общее давление в системе равно 0,3; степень превращения  .
.
7. Для реакции
2С5H10↔C10H10
Вывести уравнение парциального давления веществ и посчитать их с учетом содержания 6 мольных процентов инертных примесей и мольного соотношения реагентов 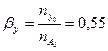 . Известно, что общее давление в системе равно 0,5; степень превращения
. Известно, что общее давление в системе равно 0,5; степень превращения  .
.
8. Для реакции
2С5H10↔C10H10
Вывести уравнение парциального давления веществ и посчитать их с учетом содержания 12 мольных процентов инертных примесей и мольного соотношения реагентов 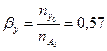 . Известно, что общее давление в системе равно 0,8; степень превращения
. Известно, что общее давление в системе равно 0,8; степень превращения  .
.
9. Для реакции
2С5H10↔C10H10
Вывести уравнение парциального давления веществ и посчитать их с учетом содержания 7 мольных процентов инертных примесей и мольного соотношения реагентов 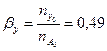 . Известно, что общее давление в системе равно 0,8; степень превращения
. Известно, что общее давление в системе равно 0,8; степень превращения 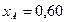 .
.
10. Для реакции
2NO + O2↔ 2NO2
Вывести уравнения парциальных давлений веществ и посчитать их с учетом содержания инертных примесей 10 мольных процентов и мольного соотношения реагентов 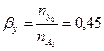 . Известно, что общее давление в системе равно 0,18; степень превращения
. Известно, что общее давление в системе равно 0,18; степень превращения 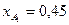 и
и 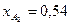 .
.
11. Для реакции
2NO + O2↔ 2NO2
Вывести уравнения парциальных давлений веществ и посчитать их с учетом содержания инертных примесей 14 мольных процентов и мольного соотношения реагентов 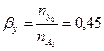 . Известно, что общее давление в системе равно 0,9; степень превращения
. Известно, что общее давление в системе равно 0,9; степень превращения 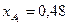 и
и  .
.
12. Для реакции
2NO + O2↔ 2NO2
Вывести уравнения парциальных давлений веществ и посчитать их с учетом содержания инертных примесей 9 мольных процентов и мольного соотношения реагентов 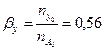 . Известно, что общее давление в системе равно 0,89; степень превращения
. Известно, что общее давление в системе равно 0,89; степень превращения 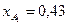 и
и  .
.
13. Для реакции
2NO + O2↔ 2NO2
Вывести уравнения парциальных давлений веществ и посчитать их с учетом содержания инертных примесей 10 мольных процентов и мольного соотношения реагентов 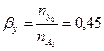 . Известно, что общее давление в системе равно 0,8; степень превращения
. Известно, что общее давление в системе равно 0,8; степень превращения 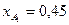 и
и 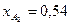 .
.
14. Для реакции
2NO + O2↔ 2NO2
Вывести уравнения парциальных давлений веществ и посчитать их с учетом содержания инертных примесей 6 мольных процентов и мольного соотношения реагентов 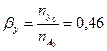 . Известно, что общее давление в системе равно 0,11; степень превращения
. Известно, что общее давление в системе равно 0,11; степень превращения  и
и 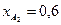 .
.
15. Для реакции
2NO + O2↔ 2NO2
Вывести уравнения парциальных давлений веществ и посчитать их с учетом содержания инертных примесей 13 мольных процентов и мольного соотношения реагентов 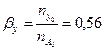 . Известно, что общее давление в системе равно 0,2; степень превращения
. Известно, что общее давление в системе равно 0,2; степень превращения 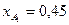 и
и 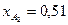 .
.
16. Для реакции
2NO + Cl2 ↔2NOCl
Вывести уравнения парциальных давлений веществ и посчитать их с учетом содержания инертных примесей 9 мольных процентов и мольного соотношения реагентов  . Известно, что общее давление в системе равно 0,18; степень превращения
. Известно, что общее давление в системе равно 0,18; степень превращения  и
и 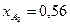 .
.
17. Для реакции
2NO + Cl2 ↔ 2NOCl
Вывести уравнения парциальных давлений веществ и посчитать их с учетом содержания инертных примесей 15 мольных процентов и мольного соотношения реагентов 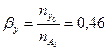 . Известно, что общее давление в системе равно 0,4; степень превращения
. Известно, что общее давление в системе равно 0,4; степень превращения  и
и 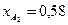 .
.
18. Для реакции
2NO + Cl2 ↔ 2NOCl
Вывести уравнения парциальных давлений веществ и посчитать их с учетом содержания инертных примесей 14 мольных процентов и мольного соотношения реагентов  . Известно, что общее давление в системе равно 1; степень превращения
. Известно, что общее давление в системе равно 1; степень превращения  и
и 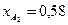 .
.
19. Для реакции
2NO + Cl2 ↔ 2NOCl
Вывести уравнения парциальных давлений веществ и посчитать их с учетом содержания инертных примесей 7 мольных процентов и мольного соотношения реагентов  . Известно, что общее давление в системе равно 0,7; степень превращения
. Известно, что общее давление в системе равно 0,7; степень превращения  и
и 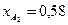 .
.
20. Для реакции
2NO + Cl2 ↔ 2NOCl
Вывести уравнения парциальных давлений веществ и посчитать их с учетом содержания инертных примесей 8 мольных процентов и мольного соотношения реагентов 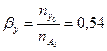 . Известно, что общее давление в системе равно 2; степень превращения
. Известно, что общее давление в системе равно 2; степень превращения  и
и 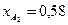 .
.
Дата добавления: 2015-08-17; просмотров: 185 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| ПРОСТЫЕ И СЛОЖНЫЕ РЕАКЦИИ | | | ГЛАВА 2. ТЕРМОДИНАМИКА ХИМИЧЕСКИХ РЕАКЦИЙ |