
Читайте также:
|
1. Вычислить летучесть изобутана при 373,2 К и Р1 = 10 и Р 2= 25атм, если V10 = 2680мл/моль, V25 = 132мл/моль по уравнению: 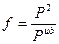
2. По уравнению 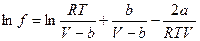 вычислить летучесть изобутана при 373,2 К, Р1 = 10 и Р2 = 25атм, если V10 = 2680мл/моль, V25 = 132мл/моль. Константа уравнения Ван-дер-Ваальса для изобутана: а = 12,876л2∙атм/моль2; b = 0,114л/моль.
вычислить летучесть изобутана при 373,2 К, Р1 = 10 и Р2 = 25атм, если V10 = 2680мл/моль, V25 = 132мл/моль. Константа уравнения Ван-дер-Ваальса для изобутана: а = 12,876л2∙атм/моль2; b = 0,114л/моль.
3. Вычислить летучесть водорода при 500 К и Р = 250атм, Ткр = 33,3 К, Ркр = 12,8атм, zкр = 0,29.
4. Вычислить летучесть аммиака при 500 К и Р = 50атм; Ткр = 405,6 К, Pкр = 112,5 атм, zкр = 0,242.
5. Вычислить летучесть изобутана при 373,2 К, давлениях 10, 25 и 80атм, Ткр = 408 К, Ркр = 36атм, zкр = 0,289.
6. Определить летучесть ацетона при 420 К и 80атм; Ткр = 508,7 К, Ркр = 46,6атм, zкр = 0,237.
7. Определить летучесть ацетона при 500 К и 90атм; Ткр = 508,7 К, Ркр = 46,6атм, zкр = 0,237.
8. Вычислить летучесть трифторхлорметана (фреон 13) при 323,2 К и 50 атм. Ткр = 304 К, Ркр = 39атм, zкр = 0,277.
9. Вычислить летучесть трифторхлорметана (фреон 13) при 352,2 К и 70 атм. Ткр = 304 К, Ркр = 39атм, zкр = 0,277.
10. Рассчитать состав равновесной смеси для реакции
С2Н4 + С4Н10↔С6Н14
| С2Н4 | С4Н10 | С6Н14 | |
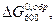 к кал \ моль к кал \ моль
| 20,92 | 24,48 | 43,78 |
| Р кр, атм | 50,8 | 36,0 | 30,7 |
| Ткр, К | |||
| zкр | 0,27 | 0,27 | 0,27 |
Реакцию проводят при 600 К и 100атм. В исходной смеси содержится по молю бутана и этилена.
11. Рассчитать состав равновесной смеси для реакции
С2Н4 + С4Н10↔С6Н14
| С2Н4 | С4Н10 | С6Н14 | |
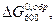 к кал \ моль к кал \ моль
| 20,92 | 24,48 | 43,78 |
| Р кр, атм | 50,8 | 36,0 | 30,7 |
| Ткр, К | |||
| zкр | 0,27 | 0,27 | 0,27 |
Реакцию проводят при 800 К и 50атм. В исходной смеси содержится по молю бутана и этилена.
12. Вычислить выход н-гептана, который возможен в случае деароматизации толуола при 800 К и 50атм
С6Н5СН3 + 4Н2↔С7Н16
| С6Н5СН3 | Н2 | С7Н16 | |
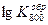
| −17,00 | −21,802 | |
| Р кр, атм | 41,6 | 12,8 | 27,0 |
| Ткр, К | |||
| zкр | 0,27 | 0,29 | 0,27 |
В исходной смеси мольное отношение толуола и водорода 1:4.
13. Вычислить выход н-гептана, который возможен в случае деароматизации толуола при 700 К и 100атм
С6Н5СН3 + 4Н2↔С7Н16
| С6Н5СН3 | Н2 | С7Н16 | |
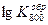
| −17,00 | −21,802 | |
| Р кр, атм | 41,6 | 12,8 | 27,0 |
| Ткр, К | |||
| zкр | 0,27 | 0,29 | 0,27 |
В исходной смеси мольное отношение толуола и водорода 1:2.
14. Вычислить выход н-гептана, который возможен в случае деароматизации толуола при 900 К и 100атм
С6Н5СН3 + 4Н2↔С7Н16
| С6Н5СН3 | Н2 | С7Н16 | |
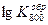
| −17,00 | −21,802 | |
| Р кр, атм | 41,6 | 12,8 | 27,0 |
| Ткр, К | |||
| zкр | 0,27 | 0,29 | 0,27 |
В исходной смеси мольное отношение толуола и водорода 1:1.
15. Рассчитать состав равновесной смеси для реакции
С2Н4 + С4Н10↔С6Н14
| С2Н4 | С4Н10 | С6Н14 | |
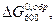 ккал/моль ккал/моль
| 20,92 | 24,48 | 43,78 |
| Р кр, атм | 50,8 | 36,0 | 30,7 |
| Ткр, К | |||
| zкр | 0,27 | 0,27 | 0,27 |
Реакцию проводят при 900 К и 80атм. В исходной смеси содержится по молю бутана и этилена.
16. Каков теоретический выход этана при 1000 К и 70атм, если при этой же температуре и 1атм он составляет 17,6 мольн. %
С2Н4 + Н2↔С2Н6
| С2Н4 | Н2 | С2Н6 | |
| Ркр,атм | 50,7 | 12,6 | 48,8 |
| Ткр, К | |||
| zкр | 0,27 | 0,23 | 0,25 |
17. Каков теоретический выход этана при 900 К и 50атм,если при этой же температуре и 1атм он составляет 13,6 мольн. %
С2Н4 + Н2↔С2Н6
| С2Н4 | Н2 | С2Н6 | |
| Ркр,атм | 50,7 | 12,6 | 48,8 |
| Ткр, К | |||
| zкр | 0,27 | 0,23 | 0,25 |
18. Каков теоретический выход этана при 700 К и 80атм,если при этой же температуре и 1атм он составляет 15,6 мольн. %
С2Н4 + Н2↔С2Н6
| С2Н4 | Н2 | С2Н6 | |
| Ркр,атм | 50,7 | 12,6 | 48,8 |
| Ткр, К | |||
| zкр | 0,27 | 0,23 | 0,25 |
19. Вычислить состав равновесной смеси, образующийся в результате крекинга н -нонана при 700 К и 50 атм, если протекают следующие реакции:
1) С9Н20↔ н -С5Н10+С3Н6+СН4
2) С9Н20↔ н -С4Н8+С3Н8+С2Н4
3) С9Н20 ↔ н -С4Н8+С3Н6+С2Н6
Константы равновесия при данной температуре: K1,f = 3,77; K2,f = 1,76; K3,f = 3,05. Для реакции взят 1моль н -нонана.
20. Вычислить состав равновесной смеси, образующийся в результате крекинга н -нонана при 800 К и 70 атм, если протекают следующие реакции:
1) С9Н20↔ н -С5Н10+С3Н6+СН4
2) С9Н20↔ н -С4Н8+С3Н8+С2Н4
3) С9Н20 ↔ н -С4Н8+С3Н6+С2Н6
Константы равновесия при данной температуре: K1,f = 4,78; K2,f = 2,76; K3,f = 4,05. Для реакции взят 2моль н -нонана.
Дата добавления: 2015-08-17; просмотров: 104 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Расчет константы равновесия при последовательно протекающих реакциях | | | ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ |