
Читайте также:
|
Средние соли могут быть получены путём взаимодействия металлов, стоящих в ряду напряжения до водорода, с кислотами:
Mg + H2SO4 → MgSO4 + H2↑ (газ)
Или с кислыми солями:
3 Zn + 3 KH2PO4 → Zn3(PO4)2 + K3PO4 + 3 H2↑
Путём взаимодействия металлов, стоящих в ряду напряжений после водорода, с кислотами- окислителями (за счет восстановления аниона – NO3−):
3 Cu + 8 HNO3 → 3 Cu(NO3)2 + 2 NO↑ + 4H2O
При взаимодействии кислот с основными оксидами:
CaO + H2C2O4 → CaC2O4 + H2O
щавелевая к-та оксалат кальция
при взаимодействии амфотерных оксидов с кислотами:
Al2O3 + 6 HNO3 → 3 H2О + 2 Al(NO3)3
При взаимодействии кислот со щелочами:
2 H3PO4 + 3 Ba(OH)2 → Ba3(PO4)2↓ + 3 H2O
При взаимодействии кислот с нерастворимыми в воде основаниями:
Bi(OH)3 + 3 HNO3 → Bi(NO3)3 + 3 H2O
При взаимодействии кислот с амфотерными гидроксидами:
Cr(OH)3 + 3 HCl → CrCl3 + 3 H2O
При взаимодействии кислот с гидросилсодержащими комплексами:
4 HNO3 + K2[Pb(OH)4] → 2 KNO3 + Pb(NO3)2 + 4 H2O
При взаимодействии кислот с аммиаксодержащими комплексами:
4 H2SO4 + [Ni(NH3)6](OH)2 → NiSO4 + 3 (NH4)2SO4 + 2 H2O
При взаимодействии кислот с аммиаком, первичными, вторичными, третичными аминами и четвертичными аммониевыми основаниями:
HClO4 + NH3 → NH4ClO4 - перхлорат аммония





При взаимодействии кислот с солями более слабых, чем они кислот:
H2SO4 + K2SiO3 → H2SiO3↓ + K2SO4
При взаимодействии нелетучих кислот с солями летучих кислот:

Соли могут получаться также при взаимодействии кислотных оксидов со щелочами,
SO2 + 2 NaOH → Na2SO3 + H2O
нерастворимыми в воде основаниями,
3 SO3 + La(OH)3 → La2(SO4)3 + 3 H2O
амфотерными гидроксидами:
P4O10 + 6 Cu(OH)2 → 2 Cu3(PO4)2 + 6 H2O
При взаимодействии кислотных оксидов с основными, кислотных оксидов с афмотерными и основных оксидов с амфотерными при сплавлении:
SO3 + Na2O → Na2SO4 SO3 + ZnO → ZnSO4 K2O + Al2O3 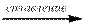 2 KAlO2
2 KAlO2
Соли могут получаться также в реакциях ионного обмена между солями:
Ba(NO3)2 + Al2(SO4)3 → BaSO4↓ + 2 Al(NO3)3
2 Na3PO4 + 3 ZnCl2 → Zn3(PO4)2↓ + 6 NaCl
В окислительно-восстановительных реакциях между солями в нейтральной:
4 NaClО + K2S → 4 NaCl + K2SO4
кислой:
3 Na2SO4 + K2Сr2O7 + 4 H2SO4 → 3 Na2SO4 + Сr2(SO4)3 + K2SO4 + 4 H2O
и щелочной средах:
Na2S + 8 KMnO4 + 8 KOH → Na2SO4 + 8 K2MnO4 + 4 H2O
Средние соли также могут быть получены путём обменных реакций других средних солей с кислотными оксидами:
K2SiO3 (раствор) + CO2(газ) → K2CO3 + SiO2↓ (гель)

Средние соли могут получаться из других солей путём реакции замещения на металл, стоящий в ряду напряжений левее металла исходной соли:
CuSO4 + Zn → ZnSO4 + Cu Mn(NO3)2 + Mg → Mg(NO3)2 + Mn
Примечание: эти реакции протекают в водных растворах, поэтому брать в качестве вытесняющего металла металлы, стоящие в ряду напряжений левее магния нельзя, так как они реагируют с водой.
Некоторые средние соли могут быть получены путём взаимодействия других солей с простыми веществами, например, кислородом или серой:
2 Na2SO3 + О2 → 2 Na2SO4 2 KNO2 + О2 → 2 KNO3 PbS + 2 О2 → PbSО4 KCN + S → KSCN
Одни трудно растворимые соли могут быть получены из других трудно растворимых солей действием на них большого избытка насыщенного раствора хорошо растворимой соли, содержащей нужный анион или катион:


Некоторые средние соли могут быть получены из других солей путём их диспропорционирования при нагревании:
4 KClO3 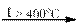 KCl + 3 KClO4
KCl + 3 KClO4
Другие путём каталитического разложения солей так же при нагревании:
2 KClO3  2 KCl + 3 O2
2 KCl + 3 O2
Некоторые средние соли могут получаться из других средних солей в результате их термического разложения:
. 4 K2Cr2O7  4 K2CrO4 + 2 Cr2O3 + 3 O2↑ 2 KMnO4
4 K2CrO4 + 2 Cr2O3 + 3 O2↑ 2 KMnO4  K2MnO4 + MnO2 + O2↑
K2MnO4 + MnO2 + O2↑
(оранжевый) (лимонно-жёлт.) (зелён.) (фиолетов) (зелёный.) (бурый)
Некоторые средние соли переходят в другие средние соли под действием кислот или щелочей:
K2Cr2O7 + 2 KOH → 2 K2CrO4 + H2O 2 K2CrO4 + H2SO4 → K2Cr2O7 + K2SO4 + H2O
дихромат калия хромат калия
Некоторые средние соли получаются при разложении комплексных солей:
[Cu(NH3)4]SO4  CuSO4 + 4 NH3↑ [Ni(NH3)6]Cl2
CuSO4 + 4 NH3↑ [Ni(NH3)6]Cl2  NiCl2 + 6 NH3
NiCl2 + 6 NH3
K2[Ni(CN)4]  Ni(CN)2 + 2KCN
Ni(CN)2 + 2KCN
Разложение красной кровяной соли:
6 K3[Fe(CN)6]  18 KCN + 2 Fe3C + N2↑ + 8 N ≡ C − C ≡ N↑ ( дициан - газ)
18 KCN + 2 Fe3C + N2↑ + 8 N ≡ C − C ≡ N↑ ( дициан - газ)
Дата добавления: 2015-08-17; просмотров: 77 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Классификация солей | | | Физические свойства средних солей |