
Читайте также:
|
Химические свойства двойных солей определяются составом входящих в них катионов и анионов. Например, сульфат алюминия натрия реагирует со стехиометрическим количеством щёлочи с выпадением осадка гидроксида алюминия:
NaAl(SO4)2 + 3 NaOH → Al(OH)3↓ + 2 Na2S
В избытке концентрированной щёлочи реакция идёт с образованием комплексной соли:
NaAl(SO4)2 + 4 NaOH → Na[Al(OH)4] + 2 Na2SO4
конц. в избытке
Эта же двойная соль за счёт своего аниона может взаимодействовать с нитратом бария:
NaAl(SO4)2 + 2 Ba(NO3)2 → Al(NO3)3 + NaNO3 + 2 BaSO4↓
При взаимодействии соли NH4Cr(SO4)2 со фторидом хрома происходит осаждение практически нерастворимого фторида хрома (III)
2 NH4Cr(SO4)2 + 6 NaF → 2 CrF3↓ + (NH4)2SO4 + 3 Na2SO4
Некоторые двойные соли за счёт входящих в их состав катионов – восстановителей могут окисляться сильными окислителями. При этом, хотя реакция проводится в кислой среде, но кислота не затрачивается, а наоборот ещё и получается: 10 KCr(SO4)2 + 6 KMnO4 + 11 H2O 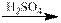 5 H2Cr2O7 + 6 KHSO4 + 6 MnSO4 + 2 K2SO4
5 H2Cr2O7 + 6 KHSO4 + 6 MnSO4 + 2 K2SO4
2 Cr3+ + 7 H2O  Cr2O72− + 14 H+ │5
Cr2O72− + 14 H+ │5
MnO4− + 8 H+  Mn2+ + 4 H2O │6
Mn2+ + 4 H2O │6
---------------------------------------------------
10 Cr3+ + 11 H2O + 6 MnO4− + 48 H+ → 5 Cr2O72− + 22 H+ + 6 Mn2+ + 24 H2O
В некоторых случаях из шонита при окислении получаются квасцы:
10 (NH4)2Fe(SO4)2 + 2 KMnO4 + 8 H2SO4 →
→ 10 NH4Fe(SO4)2 + K2SO4 + 2 MnSO4 + 14 H2O + 5 (NH4)2SO4
Эта же соль при нагревании за счёт катиона аммония реагирует со щёлочью с выделением газообразного аммиака. При этом так же происходит разложение гидроксида Fe(II) на оксид Fe(II) и воду.
(NH4)2FeSO4 + 4 KOH → 2 NH3↑ + 3 H2O + FeO↓ + 2 K2SO4
При взаимодействии с алюминием ион Cr3+ замещается на ион Al3+, а хром осаждается в виде металла:
NH4Cr(SO4)2 + Al → NH4Al(SO4)2 + Cr↓
Дата добавления: 2015-08-17; просмотров: 188 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Двойные соли | | | Применение солей |