
Читайте также:
|
Некоторые средние соли термически нестабильны и разлагаются при нагревании. Например, нитраты металлов стоящих в ряду напряжений левее магния разлагаются на нитриты и кислород:
Ca(NO3)2  Ca(NO2)2 + O2↑
Ca(NO2)2 + O2↑
Нитраты металлов, стоящих в ряду напряжений от магния до меди включительно, разлагаются на оксид металла, оксид азота IV и кислород:
4 Al(NO3)3  2 Al2O3 + 12 NO2↑ + 3 O2↑
2 Al2O3 + 12 NO2↑ + 3 O2↑
Исключение: нитрат марганца разлагается без выделения кислорода, но с образованием оксида, где марганец находится в более высокой степени окисления, чем в исходной соли:

Нитраты металлов, стоящих в ряду напряжений после меди разлагаются на металл, оксид азота IV и кислород:
Hg(NO3)2  Hg + 2 NO2↑ + O2↑
Hg + 2 NO2↑ + O2↑
Нитрат аммония разлагается на оксид азота I и пары воды:
NH4NO3  N2O↑ + 2 H2О↑
N2O↑ + 2 H2О↑
Нитрит аммония разлагается на азот и пары воды:
NH4NO2  N2↑ + 2 H2О↑
N2↑ + 2 H2О↑
Оранжевый дихромат аммония разлагается на азот, пары воды и зелёный оксид хрома:
(NH4)2Cr2O7  N2↑ + 4 H2O↑ + Cr2O3
N2↑ + 4 H2O↑ + Cr2O3
Сульфаты металлов, разлагающиеся при более низких температурах, дают оксид металла и оксид серы (VI):
Fe2(SO4)3 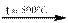 Fe2O3 + 3 SO3↑,
Fe2O3 + 3 SO3↑,
тогда как разлагающиеся при более высоких температурах ы двухвалентных железа и никеля, дают оксид металла и оксид серы (IV):
2 FeSO4  2 FeO + 2 SO2↑ + O2↑
2 FeO + 2 SO2↑ + O2↑
Сульфат свинца (II) разлагается 1000оС аналогично сульфату двухвалентного железа, а сульфат олова (II) при нагревании выше 360оС вступает во внутримолекулярную ОВР:
SnSO4  SnO2 + SO2↑
SnO2 + SO2↑
Бертолетова соль KClO3 разлагается в присутствии катализатора MnO2 на хлорид калия и кислород:
2 KClO3  2 KCl + 3 O2↑,
2 KCl + 3 O2↑,
а в отсутствии катализатора диспропорционирует на хлорид и перхлорат калия
4 KClO3 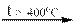 KCl + 3 KClO4
KCl + 3 KClO4
Карбонаты металлов разлагаются на оксиды металлов и углекислый газ, однако температуры, при которых это происходит, очень сильно зависят от природы металлов. Для карбоната магния это 450, кальция и натрия 1000, калия и стронция 1200оС, а для наиболее легко и наиболее трудно разлагающихся карбонатов бериллия и бария приведены ниже:
BeCO3  BeO + CO2↑ BaCO3
BeO + CO2↑ BaCO3  BaO + CO2↑
BaO + CO2↑
Многие средние соли могут реагировать с кислотами. Например, соль нестойкой угольной кислоты BaCO3 под действием сильных кислот дает соль этой сильной кислоты, воду и углекислый газ:
BaCO3 + H2SO4 → BaSO4 + H2O + CO2↑
Соли слабых кислот так же реагируют с сильными кислотами с образованием соответствующей слабой кислоты и другой соли:
K2SiO3 + 2 HCl → H2SiO3↓ + 2 KCl
Соли летучих кислот реагируют с нелетучими кислотами даже если они являются более слабыми:

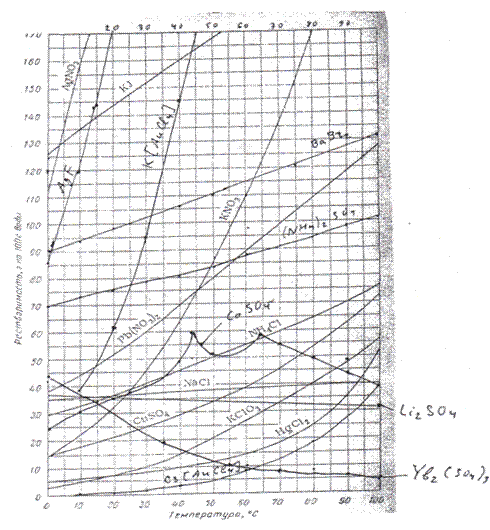
|
Рисунок. Кривые растворимости различных солей
Если кислота становится летучей при высокой температуре, то такого типа реакцию можно провести при нагревании:
KNO3 + H3PO4  HNO3↑ + KH2PO4
HNO3↑ + KH2PO4
Многие средние соли реагируют со щелочами, давая нерастворимые в воде основания, например:
La(NO3)3 + 3 KOH → La(OH)3↓ + 3 KNO3
или амфотерные гидроксиды:
CuCl2 + 2 KOH → Cu(OH)2↓ + 2 KCl
Некоторые средние соли реагируют с аммиаком и гидратом аммиака, давая аммиак – содержащие комплексы:


Многие растворимые средние соли вступают в реакцию замещения с металлами, стоящими в ряду напряжений до металлов, входящих в состав этой соли. Например:
NiSO4 + Mg → MgSO4 + Ni 3 CuCl2 + 2 Al → 2 AlCl3 + 3 Cu
Металлы, стоящие в ряду напряжений левее магния для иллюстрации этого положения брать не следует, так как они реагируют с водой и в растворе пойдут три реакции, например:
Zn(NO3)2 + 2 Na → 2 NaNO3 + Zn 2 Na + 2 H2O → 2 NaOH + H2↑
Zn(NO3)2 + 2 NaOH → Zn(OH)2↓ + 2 NaNO3
Средние соли вступают в реакцию ионного обмена с другими солями. Реакция идёт до конца в том случае, если одна из солей выпадает в осадок:
AgNO3 + NaCl → AgCl↓ + NaNO3 2 Na3PO4 + 3 Zn(NO3)2 → Zn3(PO4)2↓ + 6 NaNO3
Такого же типа реакции могут протекать между средними солями и комплексными солями, например:

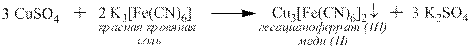
Многие средние соли вступают друг с другом в ОВР, например:
4 NaClO + K2S → K2SO4 + 4NaCl

4 ClO- + 8 H+ + S2- + 4 H2O → 4 Cl- + 4 H2O + SO42- + 8 H+
Некоторые средние соли реагируют друг с другом по-разному в зависимости от кислотности среды, например:
3 K2S + 8 Na2С2O4 + 20 H2O → 3 K2SO4 + 8 Cr(OH)3↓ + 16 NaOH

3 S2- + 12 H2O + 8 CrO42- + 8 OH- → 3 SO42- + 24 H+ + 8 Cr(OH)3↓ + 8OH- + 16 OH-
3 K2S + 8 Na2СrO4 + 8 NaOH + 20 H2O → 3 K2SO4 + 8 Na3[Сr(OH)6]

3 S2- + 12 H2O + 8 CrO42- + 16 OH- + 32 H+ → 3 SO42- + 24 H+ + 8 [Cr(OH)6]3-
Некоторые средние соли могут взаимодействовать с простыми веществами, давая другие соли
PbS + 2 O2 → PbSO4
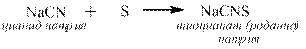
Одни трудно растворимые соли могут быть переведены в другие трудно растворимые соли путем длительного кипячения с большим избытком хорошо растворимой соли, содержащей нужный катион или анион. Метод основан на том, что даже у очень плохо растворимой соли незначительная часть ионов с поверхности кристалла уходит в раствор до установления равновесия. Если же вместо воды кристалл поместить в раствор, содержащий великое множество, например, анионов, дающих с катионом «старого» кристалла осадок, то постепенно подавляющее большинство этих катионов окажется в «новой» соли (катионы серебра в йодиде серебра, а бромида серебра практически не останется).

Аналогично переводят для аналитических целей сульфаты кальция, стронция и бария в карбонаты, которые затем переводят в хорошо растворимые хлориды:
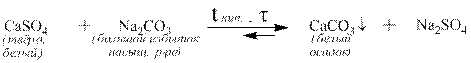
Одни ортофосфаты можно этим методом перевести в другие, например:

Дата добавления: 2015-08-17; просмотров: 135 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Растворимость средних солей | | | Кислые соли |