
Читайте также:
|
Современный уровень науки и техники требует использования высокочувствительных методов анализа, позволяющих определять микроколичества различных веществ (до 10-7% и менее). В этом плане большой интерес представляют методы, основанные на взаимодействии вещества с электромагнитным излучением в широком интервале частот,
начиная с 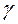 - лучей и кончая радиоволнами (табл.2).
- лучей и кончая радиоволнами (табл.2).
Таблица 2
Полный спектр электромагнитных волн
| Излучение | А, см | Е, эВ | Процессы, происходящие при излучении |
| γ - лучи | 10-11-10-8 | ~10-7 | Изменения в энергетическом состоя-нии ядер (спектроскопия- γ -резонанса) |
| Рентгеновские лучи | 10-8-10-6 | ~105 | Изменения в электронном состоянии внутренних электронов атомов (рент-геноспектроскопия) |
| Ультрафиолето-вое и видимое | 10-6-10-4 | ~10 | Изменение в энергетическом состоя-нии внешних электронов (электронные спектры) |
| Инфракрасное | 10-4-10-2 | ~10-1 | Колебания атомов в молекуле (колеба-тельные спектры) |
| Радиоволны | 10-1-102 | ~10-3 | Изменение энергетического состояния спинов электронов (спектроскопия ЭПР) |
| -//- | 103-105 | ~10-8 | Изменение энергетического состояния спинов ядер (спектроскопия ЯМР) |
К группе оптических методов анализа относятся:
- эмиссионный спектральный анализ;
- молекулярно - абсорбционный спектральный анализ;
- метод анализа по спектрам комбинационного рассеивания света;
- нефелометрический анализ;
- турбидиметрический анализ;
- люминесцентный или флуоресцентный анализы;
- радиоспектроскопический анализ.
В настоящем пособии будут рассмотрены теория и практика молекулярно - абсорбционного, нефелометрического, турбидиметрического и радиоскопичеоких методов анализа.
3.1. Молекулярно-абсорбционный спектральный анализ.
3.1,1. Теоретические основы метода. Молекулярно - абсорбционный спектральный анализ включает в себя спектрофотометрический и фотоколориметрический анализы.
Спектрофотометрический анализ основан на определении спектра поглощения или измерения светопоглощения при определенной длине волны, которая соответствует максимуму кривой поглощения данного вещества.
Фотоколориметрический анализ основан на сравнении интенсивности красок исследуемого окрашенного раствора и стандартного окрашенного раствора определенной концентрации.
3.1.1.1. Происхождение молекулярных спектров поглощения. Молекула, как и атомы, может находиться только в определенном энергетическом состоянии, например, Е0, Е1, Е2... Еn. Если излучение определенной длины волны проходит через вещество, не поглощаясь, то энергетическое состояние молекул этого вещества останется без изменений. Если же лучистая энергия поглощается, то молекулы веществ переходят из состояния с меньшей энергией Е1 в состояние с большей энергией Е2.
Согласно условию Бора, произведение волнового числа ω(v), поглощенного излучения и постоянной Планка h равно разности энергии молекул после поглощения и до поглощения:
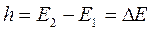 , (71)
, (71)
где
h -постоянная Планка;
Е1 и Е2 - энергия системы в начальном и конечном состоянии;
ΔЕ - изменение энергии системы.
Если анергия конечного состояния выше энергии начального состояния (Е2>Е1), т.е. ΔЕ>0то это соответствует поглощению излучения и, наоборот, при ΔЕ<0происходит излучение энергии. В первом случае мы получим спектр поглощения, а во втором - эмиссионный спектр.
Электромагнитное излучение может быть охарактеризовано либо волновым, либо энергетическими параметрами. Волновой параметр может бить выражен длиной волны Л (в А, нм, мк, ммк, с м, м) и частотой колебания v (в с-1), которые связаны между собой зависимостью:
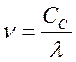 , (72)
, (72)
где Сc - скорость света.
Часто пользуются обратным значением длины волны, волновым числом ω (v), измеряемым в обратных сантиметрах (см-1). Волновое число показывает, какое количество волн данной длины укладывается на протяжении 1 см, и определяется соотношением:
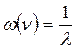 или
или 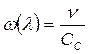 . (73)
. (73)
Поскольку величины h и Сс есть фундаментальные константы, то из соотношений (71) и (73) всегда можно произвести необходимые пересчеты. Например, длине волны 400 нм соответствует волновое число 25000 см-1.
В абсорбционном анализа наиболее важное значение имеют электромагнитные колебания со следующими длинами волн:
а) «вакуумная» ультрафиолетовая область спектра - спектр с длиной волн 200 нм (1 нм = 10-7 см = 1 ммк = 10 А);
б) ультрафиолетовая область спектра - спектр с длинами волн между 200-400 нм (200-300 нм называют дальней ультрафиолетовой областью, 300-400 нм - ближней);
в) видимая область спектра (длина волн 400-760 нм);
г) инфракрасная область спектра, находящаяся в пределах 760-20000 нм.
В инфракрасной области спектра единицей измерения длины волн служит микрон (1 мк = 10-4см).
3.1.1.2. Законы поглощения света. Окрашенные растворы обладают свойством поглощать световую энергию. Использование этого свойства в практике колориметрического анализа базируется на законе Бугера-Ламберта-Бера, который является выражением двух самостоятельно сформулированных законов.
Закон Бугера-Ламберта. Французский ученый Пьер Бугер в 1729 г. установил экспоненциальную зависимость ослабления света при прохождении его через вещество. Немецкий ученый Ламберт вывел эту же зависимость в 1760 г., изучая рассеяние света.

Рис.61. Схема световых потоков
Если световой поток с интенсивностью I0 падает на кювету с раствором, то часть его отразится от поверхности кюветы (Iотр), часть будет поглощена раствором (In) и часть пройдет через кювету (It) (рис.61). Так как Iотр - небольшая величина и ею можно пренебречь, то I0=In+It.
В результате многочисленных экспериментов Бугер и Ламберт сформулировали следующий закон: "Слои вещества одинаковой толщины, при прочих равных условиях, всегда поглощают одну и ту же часть падающего на них светового потока".
Математически эта зависимость выражается уравнением:
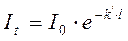 , (74)
, (74)
где
е - основание натурального логарифма;
k' - коэффициент поглощения;
l - толщина слоя.
Положив в основу десятичную систему логарифмов, получим уравнение:
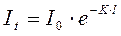 , (75)
, (75)
где K - коэффициент погашения.
Легко показать, что коэффициент погашения численно равен обратной величине толщины слоя раствора в сантиметрах, ослабляющего интенсивность проходящего через него светового потока в 10 раз:
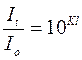 ;
; 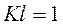 ;
;  .
.
Таким образом, поглощающая способность любого раствора может быть охарактеризована значением К. Коэффициент погашения К зависит от природы растворенного вещества и длины волны падающего света. Следовательно, первый закон поглощения справедлив только для монохроматического света, т.е. для света определенной длины волны.
Из закона Бугера-Ламберта следует, что:
а) отношение светового потока, прошедшего через слой раствора, к интенсивности падающего светового потока не зависит от абсолютной интенсивности падающего светового потока;
б) если толщина слоя раствора увеличивается в арифметической прогрессии, интенсивность светового потока, прошедшего через него, уменьшается в геометрической прогрессии.
Закон Бера. Второй закон светопоглащения был установлен в 1852 г. Изучая поглощение света растворами, Бер установил, что коэффициент погашения К. пропорционален концентрациям поглощающего вещества, т.е:
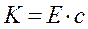 , (76)
, (76)
где
Е - коэффициент, не зависящий от концентрации;
с - концентрация вещества.
Если концентрация с выражена в г-моль/л, а толщина поглощенного слоя l - в см, то коэффициент Eназывают молярным коэффициентом погашения. Он представляет собой постоянную величину, зависящую от длины волны падающего света, природы растворенного вещества, природы растворителя, температуры раствора и соответствует погашению молярного раствора анализируемого вещества.
Закон Бера рассматривает изменение поглощения светового потока слоем постоянной толщины при изменении концентрации, а закон Бугера-Ламберта -изменение поглощения светового потока раствором постоянной концентрации при изменении толщины поглощающего слоя.
Эти законы аналогичны друг другу. Объединяя эти законы (It=I010-kl и К=ε×c), получим уравнение основного закона светопоглощения - закона Бугера-Ламберта-Бера:
 .
.
Отношение интенсивности светового потока, прошедшего через раствор It, к интенсивности падающего светового потока носит название прозрачности, или пропускания, и обозначается буквой Т:
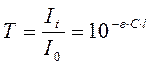 .
.
Величина Т, отнесенная к толщине слоя в 1 см, называется коэффициентом пропускания.
Логарифм величины, обратной пропусканию, носит название погашения (экcтинкции) (Е), или оптической плотности (D):
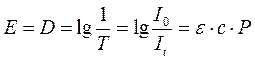 . (77)
. (77)
Из этого следует, что оптическая плотность D прямо пропорциональна концентрации вещества в растворе. Если графически изобразить зависимость 3 от с, то получим прямую линию, идущую от начала координат (рис.62).

Рис.32. Зависимость оптической плотности раствора (D) от концентрации растворенного вещества (с)
Рассмотренный график дает возможность сделать заключение о применимости к исследуемым растворам основного закона светопоглощения. Если исследуемый раствор этому закону не подчиняется, то прямолинейность нарушается на каком-то участке кривой или на всей кривой.
Существует ряд причин отклонения от закона Бугера-Ламберта-Бера:
1. Влияние посторонних электролитов, изменяющих деформацию электронных оболочек ионов, вследствие чего изменяется поглощаемость света и, соответственно, оптическая плотность.
2. Многие окрашенные соединения диссоциируют в растворах:
АВ Û А+ + В+,
причем окраска иона отличается от окраски молекулы. Интенсивность окраски, зависящая от соотношения концентраций окрашенных и бесцветных частиц, изменяется с изменением общей концентрации раствора, т.к. при этом происходит и изменение степени диссоциации. В результате при разбавлении или при концентрировании растворов наблюдаются отклонения от основного закона колориметрии.
3. Очень многие окрашенные соединения чувствительны к концентрации ионов водорода и изменяют свою окраску с изменением рН среды. При колориметрировании точное соблюдение рН среды имеет исключительное значение.
4. Большое значение в отклонении от основного закона колориметрии имеет процесс комплексообразования, например: СоСl2 + CoCl2 = Co2+ [CoCl4]2-. Раствор СаСl2 синий при высокой концентрации, розовеет при разбавлении. Одновременно с этим изменяется и молярный коэффициент погашения.
5. Окрашенные соединения часто изменяют свою окраску во времена.
6. Интенсивность окраски зависит от температуры, которая должна поддерживаться в пределах ± 1-3°С.
7. Образование окрашенного соединения часто зависит от количества, порядка добавления и концентрации реактива.
3.1.2. Классификация методов фотометрического анализа. Фотометрический метод количественного анализа основан на переведении определяемого компонента в соединение, способное поглощать свет. Количество этого продукта реакции устанавливают путем измерения светопоглощения.
В фотометрическом анализе применяют реакции различных типов. Для определения неорганических компонентов чаще всего используют реакции образования окрашенных - комплексных соединений, имеющих характерные полосы поглощения в видимой, ультрафиолетовой или инфракрасной областях спектра.
Для фотометрического определения органических компонентов чаще всего используют реакции синтеза окрашенных соединений. Ряд фотометрических методов основан на каталитическом эффекте.
Таким образом, центральное место в фотометрическом анализе занимает химическая реакция. Время, затрачиваемое на анализ, чувствительность метода, его точность и избирательность зависят в основном от выбора химической реакции и оптимальных условий образования окрашенного соединения.
Различают три группы способов измерения концентрации окрашенного соединения в растворе:
1. Визуальное сравнение. Визуально можно довольно хорошо установить равенство интенсивности окрасок или цвета двух растворов. Такой способ установления содержания окрашенного продукта реакции называют колориметрическим анализом.
2. Поглощение света измеряют при помощи приборов с фотоэлементом. Принцип работы таких приборов основан на явлении фотоэффекта. Такие приборы называют фотоэлектроколориметрами (ФЭК). Если поглощение света измеряют с помощью ФЭК, такой способ называют фотоколориметрическим анализом.
3. Наиболее совершенным прибором является спектрофотометр. В нем, кроме фотоэлемента, с помощью которого измеряется ослабление интенсивности светового потока, имеются призма или дифракционная решетка, а также щель. Это позволяет выделить узкий участок спектра, а именно тот, с которым оптически реагирует окрашенное соединение.
Измерение поглощения света спектрофотометром называют спектрофотометрическим анализом.
В теории окрашенных соединений иногда применяют специальные термины для характеристики направления сдвига спектральной полосы поглощения при различных реакциях, введении заместителей в молекулу, оценке влияния растворителя и т.п. Значение этих терминов и физический смысл соответствующих изменений окраски показаны на рис.63. Углубление цвета соответствует батохромному сдвигу, т.е. сдвигу полосы поглощения к длинным волнам (по греч «батос» - глубина). Повышение цвета отвечает гипсохромному сдвигу полосы поглощения к коротким волнам («гипсос» - высота).
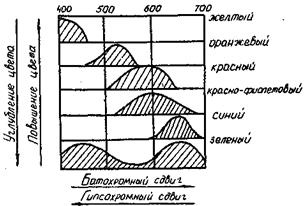
Рис.63. Характеристика сдвига спектральной полосы поглощения, восприятие цветоиспускания
3.1.3. Методы измерения оптической, плотности растворов. Как мы уже отмечали, существуют визуальные методы измерения интенсивности окраски растворов и изменения интенсивности светового потока: фотоколориметрический и спектрофотометрический анализы. В настоящее вреда значительно шире используются фотометрические методы.
 . (78)
. (78)
Из уравнения, описывающего основной закон светопоглощения очевидно, что концентрацию (с) поглощающего свет компонента можно рассчитать, если непосредственно измерить оптическую плотность раствора (D), т.е. относительное уменьшение интенсивности светового потока.
3.1.3.1. Определение концентрации вещества методом сравнения оптических плотностей эталонного и исследуемого растворов.
Данный метод основан на определении оптической плотности эталонного и исследуемого растворов. Готовят эталонный раствор определяемого вещества известной концентрации, которая приближается к концентрации исследуемого раствора. Определяют оптическую плотность этого раствора при эталонной длина волны (Dэт). Затем определяют оптическую плотность исследуемого раствора (Dх) при той жедлине волны и при той же толщине слоя.
Дляэталонного раствора имеем:
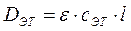 .
.
Оптическая плотность исследуемого раствора:
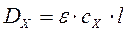 .
.
Тогда
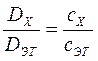 ;
; 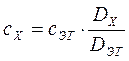 .
.
Количество (q) определяемого вещества (в мг) с учетом разбавления раствора находим по формуле:
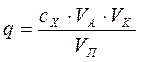 , (79)
, (79)
где
VA - объем окрашенного раствора, мл;
vk - общий объем исследуемого раствора, мл;
Vп - объем аликвотвой части исследуемого раствора, взятой для приготовлена окрашенного раствора, мл.
3.1.3.2. Определение концентрации вещества в растворе по значению молярного коэффициента поглощения. Значение молярного коэффициента поглощения ελ устанавливают следующим образом. Готовят эталонный раствор исследуемого вещества определенной концентрации сэт (моль/л) и измеряют значение оптической плотности Dэт этого раствора при длине волны λ. Значение ελвычисляют по Фошуле:
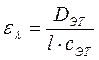 . (80)
. (80)
Затем, определив значение Dх исследуемого раствора при той же длине волны и зная £л, находим значение концентрации исследуемого вещества (моль/л):
 .
.
Количество (q ) определяемого вещества (г) находим по формуле:
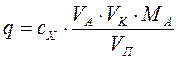 . (81)
. (81)
где МА - молекулярная (атомная) масса определяемого вещества (иона).
3.1.3.3. Определений концентрации вещества с помощью калибровочного графика. Функциональная зависимость D=k(c)между оптической плотностью раствора и концентрацией поглощающего вещества может быть установлена графически. Для этого предварительно готовят серию растворов определяемого вещества различной концентрации (эталонные растворы). Измеряют оптические плотности этих растворов с длиной волны λ и по полученным данным строят кривую зависимости оптической плотности раствора от концентрации (рис.64).
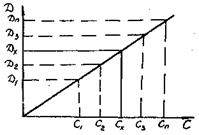
Рис.64. Калибровочный график
Определив значение оптической плотности исследуемого раствора при той же толщине слоя, находим концентрацию исследуемого вещества по калибровочному графику. Количество определяемого вещества q (мг) определяем по известной уже формуле:
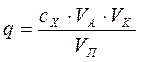
3.1.3.4. Определение концентрации вещества методом «уравнивания» или методом, изменения толщины поглощающего слоя. Оптическая плотность исследуемого раствора определяется по формуле:
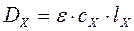 ,
,
где
ε - молярный коэффициент исследуемого раствора;
сх - концентрация определяемого вещества, мг/мл;
lx - толщина слоя, см.
Оптическую плотность эталонного раствора определяют по формуле:
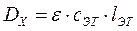 ,
,
где
Ст - концентрация эталонного раствора, мг/мл;
lэт - толщина слоя, см.
Изменяя толщину исследуемого и эталонного растворов, можно установить тождественность цвета исследуемого раствора с цветом эталонного. Тогда оба раствора будут иметь одинаковую оптическую плотность.
Отсюда
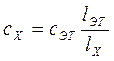 . (82)
. (82)
На использовании этого равенства основано устройство колориметра погружения (колориметр Дюбоска), в котором тождественность цвета достигается изменением толщины слоя растворов.
3.1.3.5. Определение нескольких, компонентов в растворе. Для определения двух компонентов в раствора устанавливают значения оптической плотности D1 и D2 раствора смеси двух компонентов при длинах волн λ1 и λ2 и составляют два уравнения:
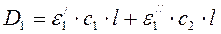 , (83)
, (83)
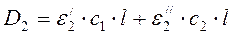 (84)
(84)
где
ε'1 и ε'2- молярные коэффициенты поглощения первого компонента при длине волн λ1, и λ2;
С1 и С2 - концентрации определяемых веществ, моль/л;
l - толщина слоя, см; ε"1 и ε''2 - молярные коэффициенты поглощения второго компонента при длине волн λ1 и λ2
Решая эти уравнения в отношении С1 и С2, находим их значения.
3.1.3.6. Определение концентрации вещества в растворе дифференциальным методом. Аппараты, которые предназначены для измерения оптической плотности растворов, снабжены двумя кюветами. Обычно в одну кювету наливают исследуемый раствор, а в другую растворитель с нулевым поглощением.
Когда же определение концентрации вещества в растворе, ведется по дифференциальному методу, в одну из кювет вместо растворителя наливают окрашенный раствор определяемого элемента с известной концентрацией С0, т.е. раствор сравнения. Оптическую плотность исследуемого раствора измеряют по отношению к раствору сравнения. Концентрация Сораствора сравнения должна быть меньше концентрации Сх исследуемого раствора.
По закону Бугера-Ламберта-Бера:
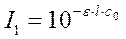 ;
; 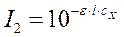 ,
,
где I1 и I2 - интенсивности световых потоков, прошедших через слой растворов сравнения и исследуемого раствора соответственно.
Тогда
 ,
,
или
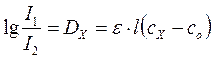 , (85)
, (85)
где Dx оптическая плотность исследуемого раствора по отношению к раствору сравнения.
Из этого уравнения следует, что между D и его концентрацией C0 существует функциональная зависимость D=f(c), которая выражается прямой (см.рис.62). Функциональную зависимость между D и C можно установить при помощи калибровочного графика. Для этого готовят серию эталонных растворов определяемого вещества и раствор сравнения определяемого вещества С0. Определяют оптическую плотность эталонных растворов по отношению к раствору сравнения (D1, D2, D3  Dn) и оптическую плотность исследуемого раствора Dx по отношению к раствору сравнения.
Dn) и оптическую плотность исследуемого раствора Dx по отношению к раствору сравнения.
Строят калибровочный график, принимая за начало отсчета концентрацию раствора сравнения Со и затем по калибровочному графину находят концентрацию Сх.
Концентрацию исследуемого раствора можно определить расчетным способом. Для этого готовят раствор сравнения с концентрацией Со, эталонный раствор определяемого элемента с концентрацией Сэг, затем находят оптическую плотность исследуемого раствора по отношению к раствору сравнения. Согласно вышеприведенной формуле:
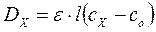 ,
,
 .
.
Отсюда
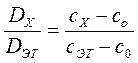 ,
, 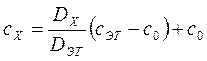 .
.
Поскольку выражение
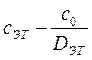 ,
,
является постоянной величиной, обозначенной F, то:
 . (86)
. (86)
3.1.4. Спектрофотометрическое титрование.
Оптические методы могут служить не только для непосредственного определения концентрации вещества, но и для определения точки эквивалентности в процессе титрования при условии, что существует линейная зависимость между величинами светопоглощения и концентрацией вещества в исследуемом растворе.
В процессе титрования отмечают значение оптической плотности и строят кривую в координатах D-V (рис.65).

Рис.65. Вид кривых титрования
3.2. Нефелометрия. Турбидиметрия.
При прохождении света через дисперсные системы наблюдается рассеяние или поглощение света твердыми взвешенными частицами. Это явление положено в основу нефелометрии и турбидиметрии (рис. 66).
При нефелометрическом анализа замеряется интенсивность рассеянного света раствором анализируемого вещества:
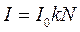 ,
,
где N - число частиц взвеси.
Интенсивность рассеянного потока прямо пропорциональна концентрации частиц, находящихся в растворе:
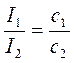 .
.
Это уравнение лежит в основе нефелометрических измерений. Интенсивности рассеянного света в двух растворах с частицами одинаковой формы и размеров соотносятся между собой, как концентрации частиц определяемого вещества.
Турбидиметрический метод основан на измерении проходящего через раствор светового потока, который уменьшается за счет поглощения и рассеяния света взвешенными частицами.
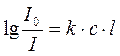 ,
,
или
 t,
t,
где к - молярный коэффициент мутности раствора.
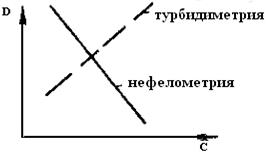
Рис.66. Характер кривых нефелометрического и турбидиметрического титрования
3.3. Абсорбционный спектральный анализ в инфракрасной области спектра. Инфракрасная спектроскопия - один из важнейших физических методов исследования строения и анализа органических и неорганических веществ.
Каждое вещество поглощает ИК-излучение специфически; иначе говоря, ИК-спектр является однозначной характеристикой веществ (дактилоскопическим отпечатком).
Сведения, полученные при анализе ИК-спектров, позволяют сделать заключение о строении и химическом составе молекул. О наличии в исследуемом соединении отдельных групп атомов и химических связей свидетельствуют так называемые характеристические полосы ИК-спектра.
3.3.1. Tеретические основы метода. Атомы, связанные в молекулу, совершают колебания около своих положений равновесия. Такое движение можно описать методом квантовой теории.
Для количественного описания спектральных линий (их частот и интенсивностей), отвечающих переходам между колебательными уровнями энергии, надо знать взаимное расположение этих уровней и знаков перехода между ними.
Расчет уровней колебательной энергии производится квантово-механическими методами. Квантование энергии получается в ходе решения уравнения Шрёдингера. Решение приводит к следующей формуле для колебательных уровней гармонического осциллятора:
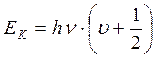 , (87)
, (87)
где v - колебательное квантовое число, которое принимает только целые и нулевые значения: 0, 1,2,3...n
При v= 0, что соответствует основному, невозбужденному состоянию:
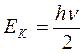 ,
,
где Ек - энергия колебаний.
При взаимодействии с электрическим полем ИК-излучения молекула переходит с основного колебательного уровня на новый, с большей величиной энергии. При этом поглощается квант электромагнитного излучения, равный разности энергий верхнего возбужденного уровня и нижнего:
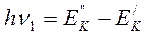 .
.
При обратном переходе молекула испускает квант энергии той же самой частоты. У гармонического осциллятора возможны переходы только между двумя соседними уровнями энергия, т.е. v может изменяться только на единицу Δ v = ±1.
Поскольку уровни энергии у гармонического осциллятора отстоят друг от друга на величину h v,то при переходах будет поглощаться или испускаться электромагнитное излучение одной частоты (равной собственной частоте колебания атомов). В спектрах наряду с колебательными переходами могут иметь место и переходы между вращательными уровнями. Рассмотренные элементы теории справедливы только для двухатомных молекул. Колебательное движение многоатомных молекул происходит гораздо сложнее. Когда молекула колеблется, то одновременно происходит движение атомов вдоль линии связи - валентные колебания и изменение валентных углов между атомами - деформационные колебания (см. рис.67).

Рис.67. Типы возможных валентных и деформационных колебаний в молекуле
Энергия деформационных колебаний значительно меньше, чем энергия валентных колебаний. Деформационные колебания наблюдаются при больших длинах волн (низких частотах).
3.3.2. Техника, измерения. Для получения ИК-спектров образец помещают на пути одного из лучей двухлучевого инфракрасного спектрофотометра. При прохождении сплошного излучения через вещество наряду с общим поглощением происходит избирательное поглощение излучения при длинах волн, отвечающих колебаниям атомов.
Приводя анализ прошедшего через вещество излучения по длинам волн, можно получить кривую избирательного поглощения, т.е. ИК-спектр (рис.68).
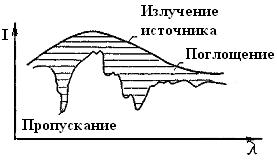
Рис.68. Избирательное поглощение при прохождений сплошного излучения через вещество
Операция разложения излучения в спектр выполняется спектральными приборами, в которых постороннее поглощение вычитается из суммарного спектра поглощения по компенсационной схеме. Приведем в упрощенном виде оптическую схему двухлучевого спектрометра (рис. 69).
Источником излучения являются силитовый стержень или нихромовая спираль. С помощью зеркал излучение разделяется на два потока одинаковой мощности. Модулятор превращает эти потоки в пульсирующее излучение. Направление потоков таково, что поток 1может попасть на зеркало, только пройдя через вырезы в диске, а поток 2-отразившись от зубца модулятора. Вновь образуется непрерывное излучение, которое направляется на входную щель диспергирующего устройства (монохронометра). Призма П разлагает это излучение в спектр. Выходная щель вырезает монохроматические составляющие спектра. Они последовательно фокусируются на приемнике Б, который преобразует тепловое излучение в электрический ток. В приемнике излучения появляется переменный ток, который усиливается и передается на реверсивный моторчик. Этот моторчик перемещает оптически клин ОК, который частично перекрывает поток и тем самым выравнивает интенсивность обоих потоков. Движение клина регистрируется на самописце пером. Получаем спектр.
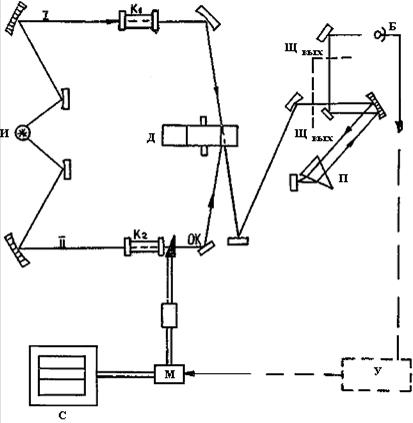
Рис.69. Оптическая схема двухлучевого спектрометра:
И - источник излучения; К1 - кювета с исследуемым веществом;
К2 - кювета с растворителем; 0К - оптический клин; Д - вращающийся диск с прорезями (модулятор); Щ - щели; П - призма, разлагающая излучение в спектр; Б - приемник излучения; У - усилитель; М - реверсивный мотор;
С - записывающее устройство.
Степень поглощения ИК-излучения определяется коэффициентом поглощения k в законе Ламберта-Бера:
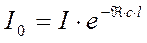 ;
;
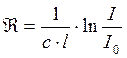 . (89)
. (89)
Интенсивность спектральных полос оценивается либо максимумом полосы поглощения, либо площадью под кривой поглощения (интегральная интенсивность). Контур полосы поглощения имеет конечную ширину; количественной мерой ее является ширина, измеренная на половине высоты полосы поглощения (рис.70). Можно получить ИК-спектры веществ, находящихся в любом агрегатном состоянии.
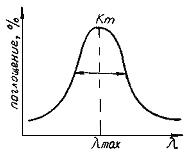
Рис.70. Вид кривой поглощения в ИК-области спектра
3.3.3. Применение в химии.
3.3.3.1. Идентификация структур. В большем числе случаев в ИК-спектрах наблюдаются полосы поглощения, которые типичны для определенных связей и групп атомов - такие полосы называются характеристическими.
Частота характеристических колебаний сравнительно мало меняется от одного соединения к другому. Можно достаточно отчетливо установить границы частот, в которых обнаруживается данное характеристическое поглощение. Этим обстоятельством и пользуются на практике для анализа состава и строения органических веществ.
Для идентификации веществ производят «разнесение» полос поглощения по химическим связям и атомным группам, наличие которых в молекуле предполагается. При этом пользуются таблицами частот колебаний и литературными данными о спектрах родственных соединений.
3.3.3.2. Изучение внутри- и межмолекулярного взаимодействия. Вопросы идентификации структуры молекул связаны с анализом причин отклонений частот и интенсивностей полос поглощения от некоторых «стандартных» значений их, полученных для узкого круга веществ. Этот анализ в большинстве случаев представляет больший интерес, чем, простая паспортизация спектральных свойств веществ.
Изучение таких отклонении позволяет судить о более тонких структурных особенностях молекул - их геометрии и конфорлации, стерических препятствиях; о взаимном влиянии атомов - индукционном и мезомерном эффектах, эффектах поля электрических диполей и т.д.; о различного рода межмолекулярных взаимодействиях.
Причиной изменения частот колебаний может быть внутреннее и внешнее окружение. Ниже приведены примеры внутри- и межмолекулярного взаимодействия бензойной, салициловой и акриловой кислот соответственно.
Внутримолекулярные взаимодействия:
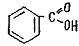 бензойная кислота
бензойная кислота 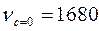
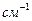
 салициловая кислота
салициловая кислота 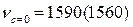
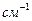
Межмолекулярные взаимодействия:
СH2 = CH = CH2 = CH Þ CH2 - CH – CH2 – CH – CH2 – CH ¾¾¾CH2
½ ½ ½ ½ ½ ½
COOH COOH COOH COOH C=O  H-O-C
H-O-C
½
OH
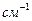
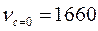
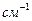
Метод ИК-спектроскопии используется также при изучении кинетики и механизма химических реакций для определения термодинамических функций системы.
Дата добавления: 2015-07-21; просмотров: 311 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА. 7 страница | | | Министерства социального развития и здравоохранения РФ |