
|
Читайте также: |
Электрохимические метода анализа основаны на использовании электрохимических процессов, происходящих в электролитической ячейке. Последняя представляет собой электрохимическую систему, состоящую из электродов, помещенных в растворы электролитов. В простейшем случае электролитическая ячейка может состоять из двух металлических электродов, опущенных в раствор электролита. Электролитическая ячейка, в зависимости от происходящих в ней процессов, может являться либо электрохимической ванной, либо гальваническим элементом.
Электрохимической ванной называется система, в которой за счет приложенного извне электрического тока происходят химические превращения веществ на электродах. Например, два платиновых электрода опущены в стеклянную емкость, содержащую 0,1М водный раствор соляной кислоты. К электродам ячейки подведен постоянный ток необходимого напряжения (рис.1). Поскольку соляная кислота в воде диссоциирует на ионы Н+ и Сl-, и к отрицательно заряженному электроду (катоду) будут двигаться ионы Н+, к положительно заряженному электроду (аноду) - ионы Cl-. Если приложенное извне напряжение постоянного тока обеспечивает достижение потенциалов разряда ионов Н+ и Сl-, то на электродах ячейки пойдут следующие электродные реакции:
- катод: 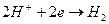 ;
;
- анод: 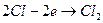 .
.
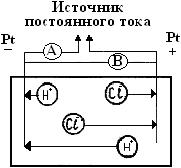
Рис.1. Электрохимическая ванна: А-амперметр; В-вольтметр
Очевидно, что вследствие этих процессов плотность электронного облака на аноде будет возрастать, а на катоде уменьшаться. Поэтому электроны от анода через металлические провода внешней цепи начнут перетекать на катод, где будут расходоваться на восстановление ионов водорода.
Таким образом, в данной электролитической ячейке, являющейся электрохимической ванной, прохождение электрического тога обеспечивается двумя видами электрической проводимости:
- металлической проводимостью проводников первого рода (платина, серебро, медь, алюминий и т.п.), в которых электрический ток представляет собой поток электронов, передвигающихся от отрицательного полюса к положительному;
- электролитической проводимостью проводников второго рода (раствора электролитов), когда электрический ток проходит через раствор электролита за счет движения находящихся в нем ионов.
Через границу раздела фаз «металл - раствор электролита» электрический ток проходит за счет электродных реакций на катоде и аноде.
Электрические параметры электролитической ячейки (сила тока, напряжение, сопротивление и т.п.) могут служить аналитическими сигналами при проведении анализов, если эти сигналы измерены с достаточной точностью. Поэтому электрохимические методы анализа основаны на использовании зависимости электрических параметров ячейки от концентрации, природы и структуры вещества, участвующего в электродной реакции или в электрохимическом процессе переноса электрических зарядов между электродами.
Электрохимические методы анализа используют либо для прямых измерений, основанных на зависимости «аналитический сигнал-состав», либо для определения конечной точки титрования.
Электрохимические методы анализа можно классифицировать следующим образом:
- методы, в которых отсутствует протекание электродных реакций, т.е. строение двойного электрического слоя  не принимается (например, кондуктометрия);
не принимается (например, кондуктометрия);
- методы, основанные на электродных реакциях в отсутствие внешнего тока (потенциометрия) или под током (вольтамперометрия, кулонометрия).
Электрохимические методы позволяют определять:
- концентрацию веществ в широком интервале (1-1×10-9 м/л);
- концентрацию веществ в мутных и окрашенных растворах;
- концентрацию смеси веществ (например, определение концентрации слабой и сильной кислоты в растворе).
Электрохимические методы анализа могут быть использованы для автоматического контроля и управления производственными процессами.
2.1. Потенциометрия.
Потенциометрический метод анализа основан на измерении потенциала электрода, погруженного в анализируемый раствор. Таким образом, аналитическим сигналом данного метода анализа является изменение электродного потенциала в процессе титрования (как будет показано ниже, практически за ходом анализа следят по изменению ЭДС, величина, которой определяется изменением потенциала индикаторного электрода).
2.1.1. Теоретические основы метода. Пластинку металлического цинка опустим в раствор сернокислого цинка (рис.2). Поскольку химический потенциал металлического цинка больше его химического, потенциала в растворе электролита, ионы цинка из металла переходят в раствор. Вследствие этого на поверхности металлического цинка скапливаются электроны, она заряжается отрицательно. В результате ионы цинка не диффундируют в глубину раствора, а скапливаются у металлической поверхности. В конечном итоге достигается динамическое равновесие - сколько ионов перешло в раствор, столько же вернулось из раствора в металл.
Таким образом, поверхность металла приобретает отрицательный заряд, а прилежащий к ней слой электролита - положительный. В результате образовывается двойной электрический слой, который представляет собой реальный физический конденсатор с плоскопараллельными обкладками. Из электротехники известно, что если обкладки плоскопараллельного конденсатора заряжены разноименно («+» и «-»), то между ними возникает скачок потенциала. Следовательно, на границе раздела фаз «металл-раствор» также возникает скачок потенциала, который называется, равновесны электродным потенциалом и обозначается буквой 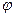 . В только что разобранном случае мы имеем дело с равновесным потенциалом
. В только что разобранном случае мы имеем дело с равновесным потенциалом 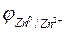 .
.
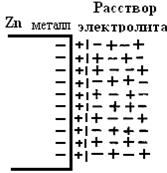
Рис.2. Двойной электрический слой (случай цинка)
Аналогичные процессы происходят и с металлической медью, опущенной в раствор сернокислой меди. Разница состоит лишь в том, что поверхность металлической меди заряжена положительно, а прилегающий слой электролита - отрицательно (рис. 3). Это является следствием того, что химический потенциал меди в растворе больше химического потенциала металлической меди. В результате на последней адсорбируются ионы Сu2+, поверхность приобретает положительный заряд, и к ней притягиваются ионы SO42-.

Рис.3. Двойной электрический слой (случай меди)
В этом случае также образуется двойной электрический слой, представляющий собой реальный физический конденсатор с плоскопараллельными обкладками. Следовательно, на границе раздела фаз «металл-раствор» возникает скачок потенциала, который является равновесным электродным потенциалом 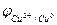 . Ясно, что
. Ясно, что 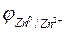 и
и 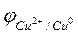 могут отличаться не только по величине, но и по знаку (обкладки реальных плоско-параллельных конденсаторов заряжены разноименно).
могут отличаться не только по величине, но и по знаку (обкладки реальных плоско-параллельных конденсаторов заряжены разноименно).
Познакомившись с возникновением электродных потенциалов, перейдем к гальваническим алиментам (рис.4). Соединим емкости с растворами CuSO4, и ZnSO4 электролитическим ключом 1, представляющим собой загнутую стеклянную трубку, заполненную хорошо проводящим электролитом, например, раствором КСl. Металлические электроды соединим проводами, присоединив к ним амперметр 3. Пока контакт 2 разомкнут, стрелка амперметра находится на нуле.
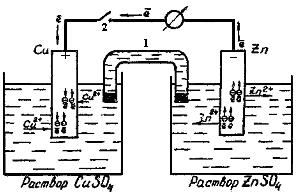
Рис.4. Схема гальванического элемента Якоби-Даниэля
При замыкании контакта амперметр покажет в не пи наличие тока. Это и естественно, т.к. мы получили электрическую цепь, в которой два электрода имеют разные потенциалы, а это, как известно, ведет к возникновению ЭДС. В результате мы получили гальванический элемент Якоби-Даниэля. Он состоит из двух полуэлементов, электролитического ключа и внешней цепи. Подобная система называется гальваническим элементом с переносом. Однако может быть случай, когда два разных электрода (например, Сu и Zn) опущены в один раствор. В этом случае электролитический ключ, естественно, отсутствует, и такая система называется гальваническим элементом без переноса.
Поскольку гальванический элемент есть система, обратная электрохимической ванне, катод в нем имеет положительный знак, а анод - отрицательный. На аноде происходит растворение цинка:
Zn0 – 2e Þ Zn2+
на катоде - осаждение меди:
Cu2+ + 2e Þ Cu0
Суммарная химическая реакция (иногда ее еще называют «токообразующая реакция») имеет вид:
Zn0 + Cu2+ Û Zn2+ + Cu0
Как и в электрохимической ванне, избыточные электроны, появившиеся на аноде в результате его растворения, через внесение в цепь переходят на катод, где расходуются на восстановление ионов Сu2+ (см. рис.4). Для простоты описания гальванические элементы часто записывает схематически. Например, элемент Якоби-Даниэля можно описать следующим образом:
Сu| +CuSO4, H2O || H2O, ZnSO4- | Zn
Гальванические элементы бывают химические и концентрационные. Химические гальванические элементы - это такие системы, в которых природа электродов и электролитов разная. Типичным примером является элемент Якоби-Даниэля. Концентрационные элементы - это такие системы, в которых электрода и электролиты одни и те же, но концентрация электролитов в полуэлементах различная.
Итак, в гальваническом элементе возникает ЭДС. В общем случае ЭДС выражается уравнением
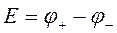 , (1)
, (1)
где
 - потенциал электрода, имеющего положительный заряд;
- потенциал электрода, имеющего положительный заряд;
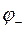 - потенциал электрода, имеющего отрицательный заряд.
- потенциал электрода, имеющего отрицательный заряд.
Таким образом, для рассмотренного нами гальванического элемента Якоби-Даниэля:
 , (2)
, (2)
где 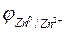 и
и 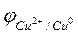 - равновесные потенциалы медного и цинкового электродов, опущенных в растворы их солей.
- равновесные потенциалы медного и цинкового электродов, опущенных в растворы их солей.
Равновесный потенциал электрода зависит от изменения активности ионов, которыми этот электрод обменивается с раствором электролита:
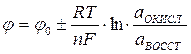 , (3)
, (3)
где
 - равновесный потенциал электрода;
- равновесный потенциал электрода;
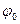 - стандартный потенциал электрода;
- стандартный потенциал электрода;
R - универсальная газовая постоянная (8,314 Дж/м);
Т - температура (К);
n - Валентность иона;
F - Постоянная Фарадея (96496 кулонов);
Aокисл - активность ионов в окисленной форме;
авосст - активность ионов в восстановленной форме.
Уравнение (3) называется формулой или уравнением Нернста и дает зависимость величины равновесного потенциала от концентрации ионов в растворе электролита. В самом деле, активность электролита связана с его концентрацией уравнением:
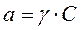 , (4)
, (4)
где
а - активность ионов электролита;
γ - коэффициент активности;
С - концентрация ионов электролита.
Следовательно, уравнение (3) можно записать в виде:
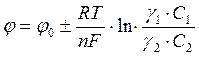 , (5)
, (5)
где
γ1 - коэффициент активности окисленной формы ионов;
С1 - концентрация окисленной формы ионов;
γ2 - коэффициент активности восстановленной формы ионов;
С2 - концентрация восстановленной фермы ионов.
Выразив в уравнении (2) значения равновесных электродных потенциалов по формуле Нернста (5), получим:
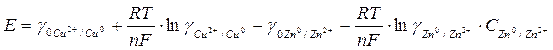 , (6)
, (6)
или окончательно:
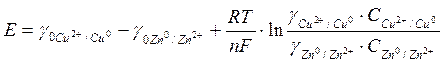 . (7)
. (7)
[ х Это потенциал электрода, опущенного в раствор электролита при 25°С, 1 атм и активности потенциалопределяющих ионов равной 1. Таким образом, для каждого металла значение ¥ 0 - величина постоянная.]
Из уравнения (7) следует, что с изменением в растворе концентрации ионов меди или цинка меняется величина ЭДС.
Основываясь на уравнениях (5) и (7), можно также объяснить возникновение ЭДС в концентрационном гальваническом элементе. Действительно, в концентрационном элементе электроды и электролиты одни и те же, например:
Cu |+ CuSO4, H2O || H2O, CuSO4- | Cu
C1 C2
Однако концентрации электролитов разные (С1>С2),
Следовательно, в соответствии с уравнением (5) потенциалы электродов будут не одинаковые. А раз имеется разность потенциалов, в электрической цепи возникает ЭДС. У рассматриваемого концентрационного элемента на катоде происходит восстановление ионов меди:
Cu2+ + 2e Þ Cu0
и их концентрация С1 уменьшается, на аноде происходит окисление меди:
Cu0 - 2e Þ Cu2+
и концентрация С2 увеличивается. Концентрационный гальванический элемент будет работать до тех пор, пока концентрации раствора сернокислой меди в обоих полуэлементах не сравняются. В этом случае электродные потенциалы у полуэлементов станут равными, и, стало быть, ЭДС равна нулю.
Кратко ознакомившись с электродными потенциалами и гальваническими элементами, перейдем собственно к потенциометрии.
В потенциометрии, в зависимости от обстоятельств, используют гальванические элементы с переносом и без переноса. При этом применяют два типа электродов; индикаторные электроды и. электроды сравнения.
Индикаторным электродом называется такой электрод, чей потенциал, в соответствии с уравнением Нернста (5), зависит от изменения концентрации ионов, которыми обменивается электрод с раствором.
Электродом сравнения называется такой электрод, чей потенциал не зависит от природы и концентрации растворов. Другими словами, потенциал электрода сравнения остается одним и тем жe в разных растворах различной концентрации.
Индикаторные электроды. Индикаторные электроды бывают двух типов - металлические и мембранные.
Металлическими индикаторными электродами называются такие электроды, у которых на границе раздела фаз «металл-раствор электролита» протекают реакции с участием электронов.
В качестве индикаторных металлических электродов используют платину, серебро, медь, кадмий, свинец, т.е. такие металлы, которые способны давать обратимые полуреакции. Потенциалы этих металлов воспроизводимы и полностью отражают активности их ионов в растворе. Однако ряд металлов, например, алюминий, железо, никель, титан, хром не могут быть использованы в качестве индикаторных электродов, т.к. для них характерны невоспроизводимый потенциалы. Это объясняется образованием на поверхности таких электродов окисных слоев, а также напряжениями и деформациями металла электродов.
Мембранными, или ионоселективными, называются такие электроды, у которых на границе раздела фаз «электрод - раствор электролита» протекают ионообменные реакции.
Ионоселективные электроды делятся на четыре группы:
1) стеклянные электроды;
2) электроды с твердыми мембранами;
3) электроды с жидкой мембраной;
4) электроды с газовыми мембранами.
Среди ионоселективных электродов наибольшее распространение получил стеклянный электрод, предназначенный для определения рН (рис.5). Он представляет собой следующее устройство. К концу толстостенной стеклянной трубка припаян тонкостенный шарик 4, изготовленный из специального pH-чувствительного стекла. Вовнутрь шарика заливается O,1 M раствор НСl, насыщенный AgCl (3). В раствор погружают серебряную проволоку, покрытую хлоридом серебра, которая и является токоотводом 2. К концу токоотвода припаивается провод, который подводится к прибору. Это устройство закрывается защитной трубкой 1.
Мембраной стеклянного электрода является тонкостенный шарик 4 (см. рис.5), изготовленный из специального стекла. Перед началом работы стеклянный электрод вымачивается в 0,1 М НСl в течение 8 часов (иначе он не будет селективен по отношению к ионам водорода).
[ х Селективность следует понимать как избирательность. Таким образом, ионоселективный электрод обменивается с раствором только одним ионом, например, только ионом Н+ или ионом Сl, хотя в электролите могут присутствовать другие ионы.].
При этом ионы водорода из раствора обмениваются на ионы натрия из стеклянной мембраны, и в системе устанавливается некоторое равновесие. Таким образом, потенциал стеклянного электрода обусловлен обменом ионов щелочных металлов, находящихся в стекле, с ионами водорода из раствора, т.е. не связан с переходом электронов. Естественно, что изменение рН раствора сдвинет равновесие, установившееся на стекле между ионами водорода и ионами щелочного металла - потенциал стеклянного электрода изменится. Обычно для изготовления рН - чувствительного стекла используются составы, содержащие 22% Na2О, 6% СаО, 72% SiO2. Стекло такого состава может быть применено до рН=9. При более высоких значениях рH мембрана становится чувствительной по отношению к ионам щелочных металлов.
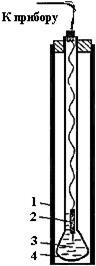
Рис.5. Стеклянный электрод
Поэтому помимо стеклянных электродов, предназначенных для измерения рН, имеются специальные стеклянные электроды для определения активности ионов Na+ и К+.
Электроды с твердыми мембранами также могут быть применены для определения концентрации ионов в растворе электролитов.
Так, в лабораторной практике широко применяют электроды с гомогенными мембранами, которые чувствительны к ионам F-, Cl- и Сu2+. В качестве твердых мембран могут использоваться такие соединения, как LaF3, АgCl-Ag2S, Cu2-xS.В этих соединениях в процессе переноса заряда участвует только один из ионов кристаллической решетка, имеющий, как правило, наименьший ионный радиус и наименьший заряд. В этом случае униполярная проводимость обеспечивает высокую избирательность электрода. Ионоселективный электрод с твердой мембраной (рис.6) состоит из мембраны 5, корпуса электрода 4, внутреннего раствора (0,1 М растворы определяемого иона и хлорида калия) 3, внутреннего полуэлемента Ag/AgCl2, места припая провода 1.
Применение электродов с жидкими мембранами основано на том, что на границе раздела фаз между анализируемым раствором и не смешивающейся с ним жидкостью возникает потенциал, обусловленный ионным обманом между двумя этими жидкостями. Таким образом, электрод с жидкой мембраной отличается от стеклянного электрода или электрода с твердой мембраной тем, что анализируемый раствор отделен от раствора с известной и постоянной активностью тонким слоем не смешивающейся с водой органической жидкости. В качестве электроактивных соединений в электродах с жидкой мембраной могут быть использованы хелаты металлов, ионные ассоциаты органических катионов и анионов, комплексы с нейтральными переносчиками.
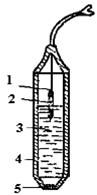
Рис.6. Ионоселективный электрод с твердой мембраной
Большое распространение получили пленочные пластифицированные электроды. Чувствительный элемент таких электродов состоит из электродноактивного компонента, поливинилхлорида и растворителя (пластификатора). Таким образом, конструкция таких электродов аналогична конструкции электродов с твердой мембраной, только вместо последней в корпус электрода вклеена пластифицированная мембрана, а внутрь электрода залит раствор сравнения. В качестве токоотвода используют хлорсеребряный полуэлемент.
Ионоселективные электроды находят все более широкое применение. Например, они широко используется при анализе и исследованиях природных и сточных вод, т.к. позволяют следить за поведением индивидуального иона, находящегося в сложной смеси, какими обычно бывают природные и сточные воды.
Электроды сравнения. Для проведения потенциометрического анализа, заключающегося в измерении ЭДС гальванического элемента,  обходим полуэлемент, потенциал которого был бы известен, постоянен и совершенно не зависел от состава исследуемого раствора. Полуэлемент, отвечающий этим требованиям, называется электродом сравнения.
обходим полуэлемент, потенциал которого был бы известен, постоянен и совершенно не зависел от состава исследуемого раствора. Полуэлемент, отвечающий этим требованиям, называется электродом сравнения.
Отметим, что электрод сравнения сохраняет практически постоянным и воспроизводимым свой потенциал даже при прохождении достаточно малых токов в растворах различных электролитов. Постоянство потенциала электрода сравнения достигается поддержанием в контактирующем внутреннем растворе постоянной концентрации веществ, на которые реагирует электрод.
В потенциометрии наиболее часто применяются хлорсеребряный и каломельные электроды сравнения.
Хлорсеребряный электрод является системой (рис.7), состоящей из стеклянного сосуда 1, внутри которого помещена серебряная проволока 2, покрытая хлоридом серебра 3 и опущенная в раствор хлорида калия 4, с исследуемым раствором такой электрод контактирует через асбестовую ткань 5.

Рис.7. Хлорсеребряный электрод сравнения
Таким образом, хлорсеребряный электрод можно представить в виде:
|| AgClTB, KCl {M} | Ag
где М - молярная концентрация КСl Электродная реакция хлорсеребряного электрода описывается уравнением AgClTB + e Û Ag0 + Cl-.
Потенциал хлорсеребряного электрода по отношению к стандартному водородному электроду равен +0,1988 при 25º С.
В заключение необходимо отметить, что различают электроды первого рода и второго рода.
Примером электродов первого рода, обратимых относительно катиона, может служить любой металл в растворе его соли. К ним же относится и газовый водородный электрод (Pt)H2, H+, поскольку на платиновом электроде при насыщении его водородом устанавливается равновесие:
2Н+ ↔ Н2 (адсорбированный)↔Н2 (газ) следовательно:
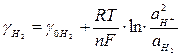 . (8)
. (8)
Электроды первого рода могут быть обратимы и относительно аниона, например, газовый хлорный электрод (Pt) Clz, Сl-, поскольку при насыщении платины хлором устанавливается равновесие:
Cl2(газ) Cl2 (адсорбированный) 2Cl-. Здесь окисленная форма - газообразный хлор, восстановленная - ион Cl-. Потенциал такого электрода равен:
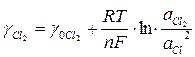 . (9)
. (9)
Электродом второго рода называется металлический электрод, погруженный в раствор труднорастворимого соединения этого металла (соль, окись) и хорошо растворимого электролита с одноименным анионом. Примерами могут служить каломельный и хлорсеребряный электроды сравнения. На каломельном электроде устанавливается равновесие:
2Hg + 2Cl- - 2e Û Hg2+ +2Cl- Û Hg2Cl2
Поскольку окисленной формой является Нg2Cl2, то
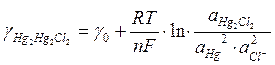 . (10)
. (10)
Рассматривая этот электрод как обратимый относительно катиона, можно представить равновесие на электроде в виде 2Hg - 2e Û Hg2+
откуда
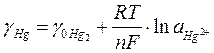 . (11)
. (11)
2.1.2. Потенциометрические измерения. Для проведения потенциометрических измерений необходимо иметь гальванический элемент, в простейшем случае состоящий из индикаторного электрода и электрода сравнения. Изменение ЭДС такого элемента фиксируется специальными приборами, о которых будет сказано ниже.
Суть потенциометрических измерений остается одна - с изменением концентрации в растворе потенциалопределяющих ионов меняется потенциал индикаторного электрода вследствие чего меняется ЭДC, изменение последней фиксируется измерительным прибором.
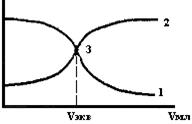
Рис.11. Потенциометрические кривые
В потенциометрическом анализе существуют прямая потенциометрия и потенциометрическое титрование.
2.1.2.1. Прямая потенциометрия. Методика таких измерений довольно проста потенциал индикаторного электрода в растворе, концентрацию которого нужно определить, сравнивается с потенциалом этого же электрода, погруженного в стандартный раствор того же вещества.
Для практических измерений этим методом cтроят калибровочный график (рис.12). Для этого измеряют потенциал индикаторного электрода в стандартных растворах с определенной активностью или концентрацией ионов. Затем определяют потенциал индикаторного электрода в растворе вещества, концентрация которого неизвестна. Откладывая полученное значение 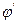 по оси ординат, определяют концентрацию вещества в растворе
по оси ординат, определяют концентрацию вещества в растворе  . Метод прямой потенциометрии сочетает в себе такие достоинства, как простота, экспрессность, возможность работы с малыми объектами растворов, доступность автоматического контроля производственных процессов.
. Метод прямой потенциометрии сочетает в себе такие достоинства, как простота, экспрессность, возможность работы с малыми объектами растворов, доступность автоматического контроля производственных процессов.
Основной трудностью использования этого метода является выбор индикаторного электрода. Он должен быть устойчивым к действию раствора, протекающая реакция должна быть обратима и идти только в одном направлении. Сочетать все эти условия для многих металлов оказывается очень сложным.
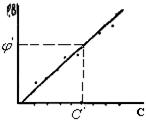
Рис.12. Калибровочный график
Однако появление ионоселективных электродов значительно расширило возможности метода, причем число методик непрерывно возрастает, В настоящее время, помимо определения ионов водорода, прямой потенциометрией определяют ионы кальция, магния, натрия, серебра, золота, ртути и т.д.
2.1.2.2. Потенциометрическое титрование. Аналитическим сигналом в этом методе также служит изменение потенциала индикаторного электрода в процессе титрования. За ходом анализа следят по показаниям прибора и результаты представляют в виде кривой титрования в координатах «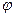 , В - объем титранта», или «рН- объем титранта». Обычно вместо кривой потенциометрического титрования «φ, В - объем титранта» строят кривую в координатах «
, В - объем титранта», или «рН- объем титранта». Обычно вместо кривой потенциометрического титрования «φ, В - объем титранта» строят кривую в координатах « , В - объем титранта», где
, В - объем титранта», где  - ЭДС гальванического элемента, величина которой определяется потенциалом индикаторного электрода (см, рис.11). По кривой потенциометрического титрования определяется эквивалентная точка 3 (см. рис.11), по которой рассчитывается концентрация определяемого вещества:
- ЭДС гальванического элемента, величина которой определяется потенциалом индикаторного электрода (см, рис.11). По кривой потенциометрического титрования определяется эквивалентная точка 3 (см. рис.11), по которой рассчитывается концентрация определяемого вещества:
Дата добавления: 2015-07-21; просмотров: 108 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| КЛАССИФИКАЦИЯ ФИЗИКО-ХИМЙЧЕСКИХ МЕТОДОВ АНАЛИЗА. | | | ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА. 2 страница |