
|
Читайте также: |
Однако не все слабые кислоты (например, с рК≤4) могут быть оттитрованы в таких смесях. Ограничения связаны с возникновением минимума на кривых титрования, сглаживающего первый излом кривой. Это сглаживание становится малозаметным для 0,1 N растворов слабых кислот, когда рК≥4 и для 0,001N растворов, когда рК≥5.
Можно принять следующие границы рК слабых кислот, определяемых в смесях с сильными кислотами:
концентрация кислоты, экв/л 0,1 0,01;
интервал, рК 4-10 5-9.
При кондуктометрическом титровании оснований различной силы кислотами характер изменения электропроводности в общем аналогичен только что рассмотренному титрованию кислот.
Часто кривые кондуктометрического титрования строят в координатах «сопротивление раствора R - объем прибавленного титранта V, мл». Поскольку сопротивление раствора есть величина, обратная его электропроводности, ход кривых титрования в этих координатах будет обратен кривым вкоординатах 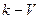 мл.Так, при титровании сильной кислоты сильным основанием сопротивление раствора R будет увеличиваться, т.к. вместо подвижного иона Н+ появляются малоподвижные ионы Na+. После точки эквивалентности дальнейшее добавление титранта вызовет уменьшение R (см. рис. 47,б, кривая 1).
мл.Так, при титровании сильной кислоты сильным основанием сопротивление раствора R будет увеличиваться, т.к. вместо подвижного иона Н+ появляются малоподвижные ионы Na+. После точки эквивалентности дальнейшее добавление титранта вызовет уменьшение R (см. рис. 47,б, кривая 1).
2.6.3.2. Измерение сопротивления растворов электролитов мостовыми схемами. Как было указано выше, прямая кондуктометрия и кондуктометрическое титрование основаны на измерении электропроводности растворов электролитов. Для этого должно быть замерено активное сопротивление между электродами, погруженными в анализируемый раствор.
Мостовая схема для измерения электрического сопротивления впервые была разработана Уитстоном. Эта схема была использована Кольраушем применительно к переменному току. В настоящее время четырехплечевой мост (рис.49) получил самое широкое распространение для измерения сопротивления растворов электролитов. Мост состоит из четырех сопротивлений:
rХ - сопротивление анализируемого раствора, залитого в ячейку, в которую опущены два электрода;
RM - магазин сопротивлений;
r1, и r 2 - постоянные сопротивления, причем r1=r 2.
Вдиагональ моста включен нуль индикатор n
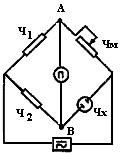
Рис.49. Четырехплечевой мост
Если питание моста осуществляется постоянным током, мы имеем дело с мостом Уитстона, если мост питается переменным током - с мостом Кольрауша.
В первом случав нуль-индикаторном служит гальванометр постоянного тока, во втором - осциллограф или специальный осциллографический нуль-индикатор.
Включим мост по схеме Уитстона и вместо электролитической ячейки с анализируемым раствором подключим к нему постоянное сопротивление (например, в 1000 Ом). Из теории мостов известно, что наивысшая чувствительность получается тогда, когда все четыре плеча имеют примерно одинаковые сопротивления. Поскольку r1=r2,то, изменяя значение rМ магазина сопротивлений, добиваемся положения, когда стрелка нуль - индикатора установится на нуле. Мост уравновешен - точки А и В находятся под одинаковым напряжением, rм =rx. Тогда можно записать баланс моста: 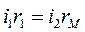 ;
; 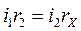 .
.
Разделим первое уравнение на второе: 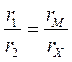 ,
,
откуда
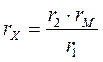 . (63)
. (63)
Сделаем следующее - в схему моста Уитcтона вместо постоянного сопротивления подключим электролитическую ячейку с анализируемым раствором rx. Тогда прохождение тока i2 через ячейку вызовет электролиз, и произойдет поляризация электродов. Поскольку явления поляризации смещают потенциал катода в область отрицательных значений, а потенциал анода - в область положительных значений, то через ячейку будет проходить ток i2+iполяризации. Установив магазином сопротивлений rмстрелку нуль-индикатора на нуль, мы уравновесим мост, но баланса моста не получим:
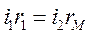 ,
,
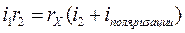 .
.
Сократить i1 и i2 уже нельзя, а rX раствора оказывается сложной функцией элементов схемы. Ошибка измерения сопротивления в этом случае сможет составлять сотни процентов, поэтому при измерении сопротивления растворов электролитов мостовыми схемами используют переменный ток, т.е. применяют мост Кольрауша. Использование переменного тока, особенно повышенной частоты (2000 - 4000 Гц), не вызывает поляризации электродов, поэтому, уравновесив мост, мы добиваемся его баланса, и значение сопротивления rм у магазина сопротивления соответствует значению сопротивления раствора электролита между электродами (rХ).
При проведении кондуктометрического титрования используются нерастворимые электроды (лучше платиновые), жестко закрепленные относительно друг друга. Исследуемый раствор перемешивается. Объем раствора в параллельных опытах должен быть одинаков.
Чувствительность моста Кольрауша не очень высока - ошибка в значениях определяемого сопротивления может составлять 10% и более. Это объясняется тем, что при прохождении через ячейку синусоидального переменного тока импеданс (см. рис.46) содержит емкостные сопротивления.
Из теории мостов известно, что мост переменного тока может быть уравновешен только в том случае, если по отдельности будут уравновешены активные и емкостные сопротивления. Поэтому параллельно магазину сопротивлений подсоединяют магазин емкостей (рис.50) и, оперируя ручками обоих магазинов, подбирают на них такие значения, чтобы высота осциллограммы была бы минимальной (у моста Кольрауша нуль-индикаторном служит осциллограф).
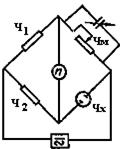
Рис.50. Мостовая схема измерения сопротивления ячейки с компенсационной емкостью
Измерения сопротивлений растворов электролитов на таком мосту можно проводить с точностью 0,5-1%, принимая при этом особые меры (тщательная экранировка проводов, симметричность монтажа, правильный подбор точки заземления и др.). Только что приведенная точность замеров означает, что при сопротивлении раствора электролита в 1000 Ом в лучшем случае будет чувствоваться изменение в 10 Ом, при сопротивлении раствора в 100 Ом - 1 Ом. Однако в ряде случаев для анализа растворов нужна более высокая чувствительность моста Кольрауша. Например, при определении сульфат-иона в сульфитном щелоке сопротивление растворов в ячейке составляло 300 Ом,- а кондуктометрическая кривая, т.е. все изменение сопротивления при титровании сульфат-иона, укладывалась в 3 Ом. Следовательно, для получения достаточной точности анализа измерять изменение сопротивления в этом случае необходимо хотя бы с точностью 0,1%, т.е. через 0,3 Ом. Этому требованию отвечает импедансный мост, разработанный профессором С. И. Ремпелем на кафедре физической химии Уральского лесотехнического института. Чувствительность этого моста в 100-1000 раз выше, чем у моста Кольрауша. С помощью разработанного моста было проведено широкое обследование технологических трактов практически всех крупнейших целлюлозно-бумажных комбинатов. Импедансный мост был удачно использован и при определении емкости ионообменных смол.
2.6.3.3. В ысокочувствительный импедансный мост для кондуктометрии. Высокая чувствительность импедансного моста (рис.51) достигается за счет применения диодов (1) в левой ветви. При этом через ячейку по-прежнему проходит переменный ток, а уравновешивание моста производится на постоянном токе (точнее, по постоянному полупериодному току). Понятно, что при этом мы измеряем не сопротивление электролита, а полное сопротивление ячейки, состоящее из сопротивления электролита и импеданса (полного переходного сопротивления границы «электрод-электролит»).
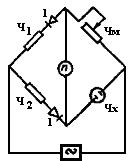
Рис.51. Схема импедансного моста высокой чувствительности
При конструировании прибора по указанной схеме и его использовании нужно учитывать следующее:
- диоды должны обладать достаточно малым сопротивлением в проводящем направлении, и это сопротивление должно быть достаточно стабильным во времени и при изменении температуры окружающей среды. Этому требованию в большей мере отвечают кремниевые диоды, например, Д-203, Д-205. Так как сопротивление диодов зависит от силы проходящего по ним тока, питание моста следует стабилизировать;
- желательно работать при соотношении плеч в цепи диодов 1:1 и приблизительном равенстве всех четырех плеч из обычных соображений наибольшей чувствительности моста;
- магазин сопротивлений желательно взять курбелъный. Если измеряемое сопротивление раствора сотни Ом, то магазин должен иметь декады на десятые и сотые доли Ома (например, магазин сопротивлений МСР-6ОМ, класс 0,02Э);
- чувствительность нуль-гальванометра должна быть не менее 0,5 10-6 А;
- питание моста может быть осуществлено от звукового генератора и от сети переменного тока. При этом нужно иметь в виду, что вследствие зависимости импеданса от частоты условия равновесия на высокой и низкой частотах будут различны. Так, ячейка с раствором, имеющая при частоте переменного тока 2500 Гц сопротивление около 100 Ом, при 50 Гц имеет сопротивление порядка 300 Ом.
В заключение приводим примерные значения параметров схемы моста для определения сульфат-иона. При титровании водных растворов сульфат-ионов питание моста осуществлялось от генератора с фиксированной частотой 2000 Гц напряжением 12 В. Сопротивление плеч моста r1 и r2100 Ом (двухваттные сопротивления MTЛ). При использовании в качестве нуль-инструмента гальванометра с ценой деления 0,5 10-6 А, деление можно было отмечать смещением его стрелки при пользовании на магазине сопротивлений декадой на сотые доли Ома. Другими словами, чувствительность составляла сотые доли Ома. С гальванометром М273/1, который имеет чувствительность 5 10-8 А, чувствительность моста составляет 0,001%.
2.6.3.4, Измерение сопротивления раствора электролита 4-эдектродной ячейкой. В некоторых не особо ответственных случаях кондуктометрическое титрование можно проводить на 4-электродной ячейке (рис.52). Идея метода проста - ток пропускают через одну пару электродов 2, а падение напряжения iR измеряет на каком-либо участке раствора с помощью второй пары электродов 3, не поляризованных током, играющих роль щупов или зондов.
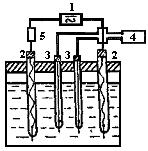
Рис.52, Четырехэлектродная ячейка для кондуктометрического титрования
Теперь несущественно, каким током питать схему - постоянным или переменным. Вопрос решается наличием подходящих источников тока 1 и измерительных приборов 4. При проведении кондуктометрического титрования на 4-электродной ячейке необходимо учесть следующий момент. В ходе титрования сопротивление раствора в ячейке будет меняться, например, увеличиваться. Но тогда, в соответствии с законом Ома, сила тона, проходящего через раствор электролита в ячейке, будет уменьшаться, апроизведение iR практически может не изменяться. Для точности анализа необходимо обеспечить постоянство силы тока, проходящего через раствор электролита в ячейке. Осуществить постоянство силы тока можно простым способом. Для этого нужно взять источник напряжения, например, трансформатор на 220 В и из них 216-218 В погасить на сопротивлении 5.
Еще одним необходимым условием в данном методе анализа является то, что напряжение на измерительных электродах нужно обязательно измерять прибором, практически не потребляющим тока (например, высокоомным катодным вольтметром).
Преимуществом методов кондуктометрического титрования является возможность определения концентрации в мутных и окрашенных растворах, концентрации веществ в их смеси, высокая точность, легкое сопряжение с типовыми средствами автоматизации и дистанционного контроля производственными процессами.
2.6.4. Низкочастотное кондуктометрическое титрование. Метод низкочастотного кондуктометрического титрования основан на измерении изменения полного переходного сопротивления границы электрод-электролит (импеданса) в процессе титрования при пропускании через электролит переменного тока низкой частоты - от 7 до 50 Гц. Таким образом, аналитическим сигналом служит изменение импеданса.
В практике весьма часто возникает необходимость определения концентрации хлора в растворах. Например, для приготовления различных растворов часто используют хлорированную воду, для этой же цели используют естественную, речную и артезианскую воду. Содержание в этих водах ионов хлора, естественно, будет различное, что может вызывать нежелательные последствия.
Так, сульфитная варка целлюлозы проводится в импортных биметаллических котлах, внутренняя поверхность которых изготовлена из нержавеющей стали, весьма стойкой в кислотных средах. Однако на Соликамском ЦБК импортные варочные котлы после установки стали быстро выходить из строя. Причина крылась в том, что естественная вода в Соликамске оказалась богата хлоридами. Последние, являясь поверхностно-активными, адсорбируется на поверхности нержавеющей стали и депассивируют ее (разрушают пассивную пленку). В результате неразъемная сталь интенсивно коррозирует, и варочный котел выходит из строя. Вследствие этого предельно допустимая концентрация Сl- в варочной кислоте и сульфитном щелоке не должна превышать 50 кг/л.
Из вышесказанного становится ясным, насколько важен контроль за содержанием Сl- при сульфитной варке.
Обычные методы аргенометрического определения Сl- неприменимы к сульфитным щелокам, турмовой и варочным кислотам и другим технологическим растворам ЦВП, поскольку они мутные и интенсивно окрашенные. Вследствие этого становится невозможным фиксирование эквивалентной точки титрования с помощью цветных индикаторов.
Несколько более точных результатов можно добиться при потенциометрическом титровании, однако при титровании растворов с концентрацией 10-20 мг/л Сl- скачок потенциалов слишком мал и растянут, поэтому эквивалентную точку определить трудно. Кроме того, на ход анализа будут влиять органические вещества, находящиеся в растворе. Органические вещества влияют и на ход кондуктометрического титрования; необходимо также отметить, что кондуктометрическое титрование основано на измерении электропроводности раствора, аизменение последней за счет связывания Cl- (Cl- +Ag+=AgCl)будет настолько незначительным на фоне присутствующих кислот, что не зафиксируется на кривых титрования.
На кафедре физической химии УЛТИ профессором С. И. Ремпелем и М.В.Бураковым разработан новый электрохимический метод анализа растворов сложного состава - низкочастотное кондуктометрическое титрование и сконструирован низкочастотный индикатор кондуктометрического титрования (НИКТ), при помощи которого можно быстро определить, в частности, концентрацию хлоридов в сульфитных щелоках и других растворах ЦБП. Важно отметить, что, в отличие от обычного метода кондуктометрического титрования, при низкочастотном титровании присутствие индифферентных хорошо проводящих электролитов (серной кислоты и др.) не мешает чувствительности определения, не снижает ее, а, наоборот, как будет показано ниже повышает чувствительность определения эквивалентной точки титрования. Таким образом, данный метод имеет повышенную чувствительность и избирательность по сравнению с другими электрометрическими методами анализа. Например, азотнокислым серебром в кислой среде (30-50%Н2S04) можно оттитровать до 0,17 мг/л иона.
Низкочастотное титрование позволяет контролировать конец титрования по величине фарадеевского импеданса электродов при стационарном потенциале или по изменению емкости двойного электрического слоя в ходе титрования. Форма кривых титрования весьма характерна - например, кривая титрования растворов хлоридов азотнокислым серебром имеет в эквивалентной точке резкий излом.
Помимо определения концентрации прибор и сам метод могут быть применены для исследования физико-химических процессов, протекающих в объеме раствора и на электродах. Метод низкочастотного титрования может быть использован для изучения химических реакций и равновесий в растворе, адсорбционных процессов на электродах, определения коэффициентов диффузии и переходных коэффициентов электрохимической реакции.
2.6.4.1. Теоретические основы метода. В основу низкочастотного титрования положено измерение полного переходного сопротивления границы «электрод-электролит», называемого импедансом, при пропускании переменного тока достаточно низкой частоты (7-50 Гц). Сопротивление раствора при этом элиминируется наличием проводящего фона. При соблюдении этих условий в значительном числе случаев оказывается, что изменение импеданса электродов несравненно более резко и четко указывает на конец титрования, чем изменение собственно проводимости раствора (рис.53). Метод низкочастотного титрования особенно выгоден для окислительно-восстановительных реакций и реакций осаждения.
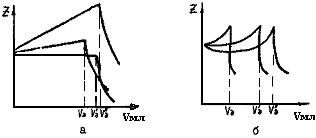
Рис.53. Кривые низкочастотного кондуктометрического титрования:
а- для малых концентраций НСl (1-5 мг/л) в присутствии 50% H2S04;
б- слабоконцентрированного раствора соли Мора на фоне 2NH2S04
Электрохимические явления на границе "электрод-электролит", происходящие в электролитической ячейке, моделируются следующей схемой (рис.54):
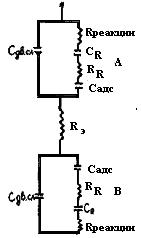
Рис, 54. Схема импеданса электродов электролитической ячейки
А - схема, моделирующая электрохимические явления на одном электроде ячейки; данную схему называют импедансом электрода; В -схема, моделирующая электрохимические явления, или импеданс, на другом электроде ячейки; Rэ - сопротивление электролита между электродами ячейки.
Из рис.54 следует, что полное переходное сопротивление границы «электрод-электролит» (или импеданс) для каждого из электродов слагается из:
Сдв. сл - емкости двойного электрического слоя, не зависящей от частоты переменного тока; iRреакции - активного сопротивления, моделирующего химическую поляризацию, обусловленного энергетическими затруднениями самого электрохимического акта разряда, также не зависящего от частоты переменного тока; СR и RR - емкостного и активного компонентов, моделирующих концентрационную поляризацию электродов; Сr и RR зависят от частоты переменного тока:
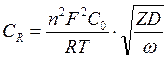 , (64)
, (64)
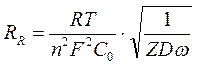 ,
, 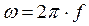 , (65)
, (65)
где
f - частота переменного тока;
Садс - реактивный компонент, моделирующий адсорбционные явления на электродах и зависящий от частоты переменного тока.
Правая цепочка схемы, моделирующей импеданс электрода, состоящая из Cадс, Rреакции, СR и RС, называется фарадеевской частью импеданса, или фарадеевской проводимостью.
Существуют обратимые и необратимые электрохимические системы. К необратимым электрохимическим системам относятся такие, в которых на электродах ячейки происходят окислительно-восстановительные реакции. Например, на электродах ячейки в растворе НCl при достижении необходимой разности потенциалов начинается процесс электролиза: на катоде идет восстановление ионов Н+:
2H+ + 2e Þ H2
на аноде, в зависимости от величины плотности тока, происходит либо окисление ионов Сl-:
2Cl- - 2e Þ Cl2,
либо окисление молекул воды:
2H2O – 4e Þ O2 + 4H+.
Количество выделившегося газа, в соответствии с законом Фарадея, пропорционально количеству электричества, прошедшего через электролит. Как отмечалось ранее, любой электрохимический процесс сопровождается концентрационной или химической поляризацией; в некоторых процессах имеют место оба вида поляризации.
Согласно рис.54, Rреакциимоделирует химическую поляризацию, RR и СR - концентрационную.
Таким образом, в необратимых электрохимических системах изменение импеданса границы «электрод-электролит» при низкой частоте пропускаемого тока определяется изменением фарадеевской части импеданса (точнее, изменением CR и RR, зависящих от частоты). В обратимых электрохимически системах на электродах практически нет окислительно-восстановительных, реакций и, следовательно, процесс электролиза отсутствует. В этом случае через электролит проходит остаточный ток, возникающий вследствие адсорбционных явлений на электродах. Следовательно, фарадеевской частью импеданса можно пренебречь и величина импеданса границы «электрод-электролит» в этом случае будет определяться изменением емкости двойного электрического слоя Сдв.сл (см. рис.54). В методе низкочастотного титрования возможны оба вышеотмеченных случая.
Если при титровании до и после точки эквивалентности возникает необратимая система (например, I/I-; Fe3+ / Fe2+), то изменения импеданса при низкой частоте пропускаемого тока определяется изменением фарадеевской части импеданса, зависящей от концентрации.
Если при титровании до и после точки эквивалентности существуют только обратимые системы, то фарадеевской частью импеданса можно пренебречь, все изменения импеданса в этом случае связаны с изменением емкости двойного электрического слоя.
Именно этот случай имеет место при титровании Cl- азотнокислым серебром в присутствии платиновых электродов. При пропускании через такую систему тока порядка 10-20 мкА (при таком токе падение напряжения на платиновых электродах составит величину порядка 5-15 мВ) потенциалы выделения ионов исследуемого раствора не достигаются, т.е. реакций разряда на электродах нет. Если в исследуемый раствор добавить электролит, обладающий хорошей проводимостью (фон), например, серную кислоту, то сопротивлением электролита можно пренебречь. Тогда импеданс электрода будет определяться только изменением емкости двойного электрического слоя Сдв.сл.:
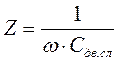 . (66)
. (66)
Ионы Сl-, являясь поверхностно-активными, адсорбируются на активных центрах поверхности платиновых электродов, снижая тем самым емкость двойного электрического слоя. В соответствии с уравнением (66) величина 2 возрастает. При титровании раствора, содержащего Cl-, азотнокислым серебром в результате реакции Ag+ + Cl- Þ AgClß сначала будут связываться в осадок ионы Сl-, содержащиеся в электролите (не адсорбированные на электродах). Поскольку это явление не будет сказываться на величине Сдв.сл., то величина Z будет, в принципе, оставаться постоянной. Но как только наступит момент, когда все ионы Cl-,находящиеся в электролите, будут связаны в AgCl. Следующие добавления AgN03 поведут к тому, что в AgClбудут связываться ионы Cl-,адсорбированные на электродах. Десорбция ионов Cl-с поверхности платиновых электродов поведет к резкому возрастанию емкости двойного электрического слоя и, следовательно, к уменьшению Z. Уменьшение Zбудет продолжаться до тех пор, пока все ионы Cl-не десорбируются с поверхности платиновых электродов и не свяжутся в AgCl. Момент начала десорбции ионов Cl-, ведущий к уменьшению Z, четко фиксируется на графике п -V, мл, где n - показания прибора в относительных единицах (рис.55):
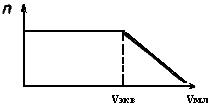
Рис.55. Кривая низкочастотного титрования при определении в растворе концентрации ионов Cl-
2.6.4.2. Схема прибора НИКТ. Измерение величины импеданса в приборе низкочастотного измерителя конца титрования (НИКТ) осуществляется по методу амперметра-вольтметра (рис.56). При постоянном значении Z катодный вольтметр будет показывать одно и тоже значение. Ясно, что увеличение Сдв.сл, ведущее к уменьшению Z, тут же зафиксируется катодным вольтметром - стрелка прибора отклонится в сторону меньших значений.
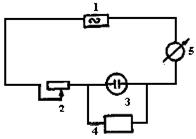
Рис.56. Принципиальная схема измерений при низкочастотном титровании: 1- источник переменного тока; 2-переменное сопротивление;
3- ячейка; 4- катодный вольтметр; 5- микроамперметр
Для практического проведения анализов разработано несколько схем прибора для низкочастотного титрования. Одна из простейших схем, рассчитанная на использование тока промышленной частоты, приведена на рис.57. Так как сопротивление диодов зависит от силы проходящего по ним тока, питание прибора следует стабилизировать.
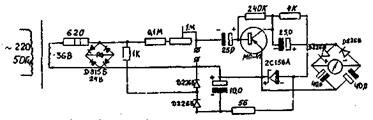
Рис.57. Схема низкочастотного индикатора кондуктометрического титрования (НИКТа), разработанного и изготовленного на кафедре физической и аналитической химии УЛТИ
2.6.4.3. Примеры применения НИКТа. Обработка раствора перед анализом. Для того, чтобы выделить из общего импеданса интересующую нас компоненту - емкость двойного электрического слоя на электродах а свести к минимуму колебания омического сопротивления раствора (Rэ), титрование ведут в сильно кислой среде (50% серной кислоты по весу). Поскольку сульфитные щелока содержат редуцирующие вещества (сахара, альдегиды, муравьиную кислоту и прочее), восстанавливающие азотнокислое сеpебрo до металлического в ходе титрования хлоридов, они должны быть предварительно разрушены.
Это осуществляется обработкой аликвотной части щелока перекисью водорода в щелочной среде. Обработка щелока перекисью водорода в кислой среде не может быть применима, т.к. при ней хлор-ион окисляется в сопряжении с сахарами до свободного хлора и теряется.
Определение концентрации Сl - в водопроводной, речной и артезианской воде. Поскольку в данной работе редуцирующие вещества отсутствуют, специальной обработки исследуемого раствора не проводят. В стакан берут 10-20 мл воды, добавляют 25 мл 23N H2S04, 10 мл дистиллированной воды, после чего раствор охлаждают. Электроды опускают в стакан, включают мешалку и ждут 5-10 минут. Для установления адсорбционного равновесия электроды должны быть полностью покрыты раствором. Затем начинают титрование добавляя
по каплям 0,025 N AgN03 (см.рис.55). По результатам титрования строят кривую показания прибора n - V, мл AgN03. Определяют количество мл AgNo3в эквивалентной точка и рассчитывают концентрацию Cl-:
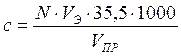 , (67)
, (67)
где
N - нормальность раствора;
Vэ - объем азотнокислого серебра, затраченного на титрование пробы до эквивалентной точки, мл;
Vпр - объем пробы, мл;
35,5 - грамм-эквивалент хлор-иона.
После первого титрования проводят второе, добавляя серебро меньшими объемами.
Определение Сl- в сульфитном котловом щелоке. Отбирают пипеткой 10 мл раствора в стаканчик емкостью 50 мл, причем в отобранную аликвотную часть не должны попадать волокна целлюлозы. Прибавляют 1,35 мл 2N- раствора NаOH. Раствор после этого должен реагировать со щелочью на фенолфталеин. Эта дозировка выбрана для нормальных Соликамских щелоков сульфитной варки на смешанном кальциево-натриевом основании, имеющих рН 1,7-1,8. Если щелок более кислый или если изменилось основание, то необходимое количество щелочи должно быть заново установлено построением кривой потенциометрического титрования щелока раствором NаОН. Выбираем количество щелочи, дающее со щелоком рН=11. Если приготовленный раствор щелочи не точно 2N, то ее объем увеличивается или уменьшается пропорционально фактической нормальности. Прибавляют 1 мл перекиси водорода, закрывают стеклом, дают стоять до опадения обильной пены при размешивании. Раствор при этом немного разогревается (до 35-45°). Когда пена опала, добавляют еще 1 мл перекиси водорода, размешивают и осторожно нагревают до кипения, которое ведут 2-3 мин до разложения избытка перекиси и начала кипения раствора крупными пузырями. Снимают стакан с плитки, добавляют еще 1мл перекиси водорода, после чего повторяют кипячение. Охлаждают стаканчик в воде, добавляют 25 мл 23 N раствора серной кислоты, после чего вновь охлаждают разогревшийся от кислоты раствор с выпавшим коричневым осадком лигносульфоновых кислот. Затем проводят титрование раствора, как указано выше.
Дата добавления: 2015-07-21; просмотров: 276 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА. 5 страница | | | ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА. 7 страница |