
|
Читайте также: |
 , (14)
, (14)
где
N1 - определяемая концентрация вещества в растворе, г-экв/л;
V1 - объем пробы исследуемого раствора, мл;
N2 - концентрация титранта;
V2 - эквивалентный объем титранта.
При определении концентрации вещества в растворе методом потенциометрического титрования необходимо иметь в виду следующее:
- чувствительность метода определяется правильным выбором индикаторного электрода;
- величина скачка потенциала вблизи эквивалентной точки тем больше, чем выше концентрация исследуемого раствора;
- величина скачка потенциала зависит также от константы ионизации слабой кислоты илислабого основания, и тем больше, чем больше соответствующая контакта;
- в случае титрования смесей двух или более веществ сначала оттитровывается вещество, имеющее более высокую степень ионизации, окислительно-восстановительный потенциал, величину ПР или устойчивость образующегося комплексного соединения;
- в начале титрования титрант можно приливать большими порциями, а вблизи эквивалентной точки - одинаковыми порциями не более 0,2 мл.
Различают следующие способы потенциометрического титрования: осаждение, перевод в малодиссоциированные комплексы, окислительно-восстановительное титрование, кислотно-основное титрование (иногда его называют «метод нейтрализации»).
Разберем эти способы потенциометрического титрования.
Осаждение. Сущность способа заключается в следующем: кизучаемому раствору добавляется такой титрант, который дает с ионами, концентрацию которых нужно определить, малорастворимое соединение, выпадающее в осадок (нужно подобрать такой индикаторный электрод, который обменивается с электролитом осаждаемыми ионами). Тогда в процессе титрования концентрация потенциалопределяющих ионов будет уменьшаться (т.к. они будут переходить в осадок), что в соответствии с уравнением Нернста (5) поведет к изменению потенциала индикаторного электрода.
Рассмотрим пример определения концентрации ионов серебра в водном растворе AgNO3 (рис,13). Индикаторным электродом будет служить серебряная проволока 2, а электродом сравнения - каломельный полуэлемент 3; в качестве титранта возьмем раствор хлористоводородной кислоты. При добавлении титранта к исследуемому раствору AgNO3 (при перемешивании на магнитной мешалке 4) ионы Ag+ будут переходить в осадок (ПPAgCl=1,7·10-10):
Ag+ + Cl- Þ AgClß
ЭДC элемента, изображенного на рис.13.
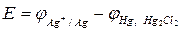 , (15)
, (15)
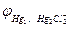 - величина постоянная, следовательно, ЭДC определяется значениями
- величина постоянная, следовательно, ЭДC определяется значениями 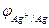 , которые зависят от изменения концентрации (точнее, активности) ионов Ag+в растворе.
, которые зависят от изменения концентрации (точнее, активности) ионов Ag+в растворе.
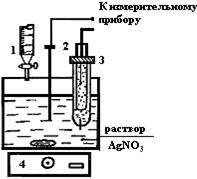
Рис.13. Гальванический элемент для определения концентрации ионов
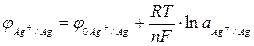 , (16)
, (16)
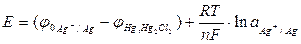 . (17)
. (17)
В процессе титрования раствора AgNO3 раствором HCl концентрация ионов Ag+в исследуемом растворе будет снижаться, что повлечет за собой уменьшение ЭДС. Строят график зависимости изменения ЭДС от объема добавленного титранта (осадителя). Получаем характерную кривую потенциометрического титрования (рис.14).

Рис.14. Кривая потенциометрического титрования нитрата серебра хлоридом по методу осаждения
Как видно из рисунка, в точке эквивалентности происходит резкий скачок ЭДС, определяемый изменением потенциала индикаторного электрода. Конечную точку титрования 1 (или точку эквивалентности) определяют как среднюю точку участка, соответствующего вертикальному ходу кривой. Очевидно, что точность данного способа тем выше, чем больше величина скачка потенциала. При этом следует иметь в виду, что скачок потенциала и. следовательно, ЭДС тем больше, чем выше концентрация титруемого раствора и титранта, и чем меньше ПР образующегося осадка. Рассмотрим кривые потенциометрического титрования ионов серебра (рис,15,а) иодидом 1 (ПРAgI=10-16) и хлоридом 2 (ПРAgCl=10-10). Поскольку ПРAgI<ПPAgCl, величина скачка потенциала для случая иодида больше, чем для хлорида. Причем чем выше концентрация нитрата серебра, тем больше скачек потенциала (рис.15,б):
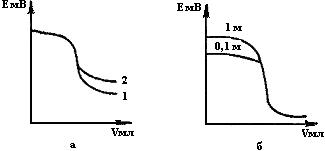
Рис.15. Кривые потенциометрического титрования раствора:
нитрат серебра хлоридом и иодидом (а),
1NHCl при различии концентрации раствора нитрата серебра (б)
По данному способу возможно титрование смеси ионов. При этом необходимо помнить, что дифференциальное титрование этих ионов возможно только в том случае, если ПР образующихся малорастворимых соединений отличаются друг от друга не менее чем на три порядка. Если при потенциометрическом титровании способом осаждения могут встречаться следующие ошибки: явления адсорбции, изменение растворимости осадка в присутствии посторонних электролитов и т.п.
Переведение в малодиссоциированные комплексы. Сущность данного способа заключается в следующем: при добавлении титранта к исследуемому pacтвоpу количество ионов, концентрацию которых нужно определить, уменьшается, т.к. они связываются в малодиссоциированный комплекс. В связи с этим будет изменяться потенциал индикаторного электрода и, следовательно, ЭДС гальванического элемента.
Рассмотрим пример титрования цианид-ионов раствором нитрата серебра. Индикаторным электродом гальванического элемента служит серебряная проволока, электродом сравнения - каломельный полуэлемент. Титрантом является раствор нитрата серебра.
Ионы серебра с ионами цианида образуют комплекс [Ag(CN)2], причем процесс комплексообразования обратим:
Ag+ + 2CN- Û [Ag(CN-)2]-
Константа нестойкости этого комплекса равна:
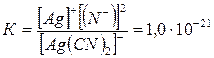 . (18)
. (18)
Воспользовавшись этой формулой, можно рассчитать концентрацию ионов серебра, а по формуле Нернста (5) - потенциал серебряного электрода. В процессе титрования потенциал последнего и, следовательно, ЭДС гальванического элемента будут возрастать (рис.16,а), и в точке эквивалентности 1 обнаружится резкий скачок потенциала. При дальнейшем титровании вслед за скачком потенциала, соответствующим
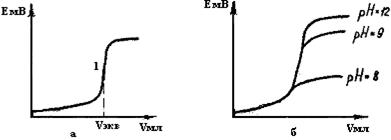
Рис.16. Кривые потенциомётрического титрований по способу комплексообразования: цианид-ионов раствором нитрата серебра (а); ионов кальция раствором ЭДТА (б) при различных рН окончанию процесса комплексообразования, возникает почти горизонтальный участок.
Это объясняется тем, что дальнейшее добавление нитрата серебра ведет к образованию в растворе малодиссоциированного осадка:
[Ag(CN-)2]- + Ag Þ 2AgCNß
Таким образом, концентрация ионов серебра в растворе, от которой зависит величина потенциала индикаторного электрода, определяется растворимостью образующегося осадка. До тех пор, пока весь комплекс не превратится в осадок, потенциал системы остается практически постоянным.
Скачок потенциала в точке эквивалентности тем больше, чем меньше константа диссоциации комплекса и чем больше начальная концентрация титруемого раствора.
При использовании большинства органических комплексообразующих лигандов процесс титрования сильно зависит от рН раствора, так как при различных рН образуются комплексы с различной константой нестойкости и различного состава. На рис.16,б приведены кривые потенциометрического титрования ионов Са2+ раствором динатриевой соли этилендиаминтетра-уксусной кислоты (ЭДТА) при различных рН. Очевидно, что при рН=8 точка эквивалентности будет определена менее правильно, нежели при рН=9 или рН=12.
Окислительное титрирование. При протекании окислительно-восстановительной реакции в растворе имеются ионы в окисленной и восстановленной форме. Если подобрать индикаторный электрод, обратимый относительно этих ионов, то по мере течения реакции концентрация ионов, находящихся в окисленной и восстановленной форме, будет изменяться. Тогда, в соответствии с формулой Нернста, будет меняться величина электродного потенциала и, следовательно, ЭДС гальванического элемента.
В качестве примера окислительно-восстановительного титрования рассмотрим процесс титрования хлорида железа (III) раствором хлорида олова (II)
2Fe3+ + Sn2+ Þ 2Fe2+ + Sn4+
Стандартные потенциалы электродных процессов равны:
2Fe3+ + 2e Þ 2Fe2+ 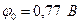
Sn2+ + 2e Þ Sn4+ 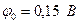
Так как  , то ион Fe3+ будет окислять ион Sn2+. Составим гальванический элемент, в котором индикаторный электродом служит платина 2, электродом сравнения - каломельный полуэлемент 3, и заполним его хлоридом железа(III) (рис.17). Титрантом является раствор хлорида олова I, перемешивание осуществляется магнитной мешалкой 4. Потенциал платинового индикаторного электрода в растворе хлорида железа (III) описывается уравнением:
, то ион Fe3+ будет окислять ион Sn2+. Составим гальванический элемент, в котором индикаторный электродом служит платина 2, электродом сравнения - каломельный полуэлемент 3, и заполним его хлоридом железа(III) (рис.17). Титрантом является раствор хлорида олова I, перемешивание осуществляется магнитной мешалкой 4. Потенциал платинового индикаторного электрода в растворе хлорида железа (III) описывается уравнением:
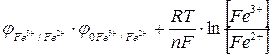 . (19)
. (19)
Тогда ЭДС гальванического элемента можно записать в виде:
 . (20)
. (20)
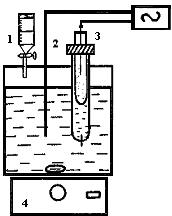
Рис. 17. Установка для окислительно-восстановительного потенциометрического титрования
Естественно, что изменение концентраций ионов Fe3+ и Fe2+ в процессе титрования повлечет за собой изменение величины 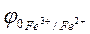 и, следовательно, ЭДС гальванического элемента, которое зафиксируется измерительным прибором.
и, следовательно, ЭДС гальванического элемента, которое зафиксируется измерительным прибором.
В процессе титрования раствора хлорида железа(III) раствором хлорида олова (II) (рас.18) электродный потенциал 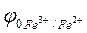 и, следовательно, ЭДС гальванического элемента вначале незначительно уменьшаются, в точке эквивалентности I происходит резкий скачок потенциала, а затем он начинает изменяться на незначительную величину. В результате получается характерная кривая потенциометрического титрования.
и, следовательно, ЭДС гальванического элемента вначале незначительно уменьшаются, в точке эквивалентности I происходит резкий скачок потенциала, а затем он начинает изменяться на незначительную величину. В результате получается характерная кривая потенциометрического титрования.
Скачок потенциала в точке эквивалентности тем больше, чем больше разность стандартных окислительно-восстановительных потенциалов и концентрация титруемого раствора и титранта.
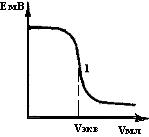
Рис.18. Потенциометрическая кривая титрования раствора железа (III) раствором хлорида олова (II)
Кислотно-основное титрование. Титрование сильных и слабых кислот сильными и слабыми основаниями (и наоборот) связано с изменением концентрации ионов водорода Н+ в растворе. Поэтому индикаторным электродом гальванического элемента в этом случае наиболее часто служит стеклянный электрод 1 (рис.19). Электродом сравнения обычно служит каломельный полуэлемент 2 (или хлорсеребряный).
Поскольку потенциал стеклянного электрода обусловлен обменом ионов щелочных металлов, находящихся в стекле, с ионами водорода из раствора, то изменение концентрации последних в исследуемом растворе при титровании повлечет за собой изменение электродного потенциала и ЭДС элемента.
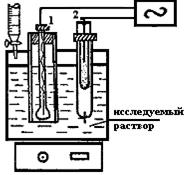
Рис.19. Установка для кислотно-основного потенциометрического титрования
При титровании раствора сильной кислоты раствором сильной щелочи (или наоборот) происходит уменьшение концентрации ионов H+ например:
HCl + NaOH = H2O + NaCl
или
H+ + OH- = H2O
Это ведет к уменьшению потенциала индикаторного электрода и, соответственно, к уменьшению ЭДС. В результате получается типичная кривая потенциометрического титрования с резким скачком потенциала в эквивалентной точке (рис.20, кривая 1).
Таким образом, потенциал индикаторного электрода при кислотно-основном титровании будет зависеть от рН раствора. Действительно, если в качестве индикаторного электрода взять стеклянный электрод, то в этом случае
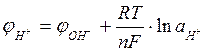 (21)
(21)
Так как стандартный потенциал водородного электрода 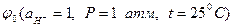 принят за нуль, то
принят за нуль, то

Поскольку 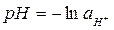 окончательно имеем:
окончательно имеем:
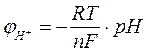 (22)
(22)
Сложнее обстоит дело при титровании слабых кислот и оснований, особенно в случае, когда титрант тоже является либо слабым основанием, либо слабой кислотой.
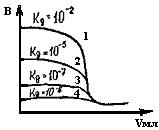
Рис.20. Кривая потенциометрического титрования кислот разной силы сильным основанием
Это объясняется тем, что слабые кислоты или основания диссоциируют не полностью, поэтому концентрация ионов Н+ в растворе заметно меньше, чем при диссоциации сильных кислот или оснований. Кроме того, в процессе титрования слабых кислот или оснований в растворе будет получаться буферная смесь остатков, например, слабой кислоты и ее соли, образующейся в процессе нейтрализации. Все это ведет к тому, что при титровании слабых кислот или оснований получается потенциометрическая кривая с небольшим скачком потенциала в точке эквивалентности (рис.20, кривая 2). В связи с этим очень слабые кислоты и очень разбавленные растворы титровать вообще нельзя, т.к. на кривой титрования не будет скачка потенциала и, следовательно, не будет обнаружена эквивалентная точка (рис.20, кривая 4). Поэтому при титровании слабых кислот и оснований нужно учитывать их константу диссоциации. Чем больше константа диссоциации, тем больше степень диссоциации слабой кислоты и, следовательно, выше концентрация ионов H+ в растворе. В результате величина скачка потенциала на кривой титрования больше и можно более точно определить точку эквивалентности (см. рис.20). Скачок потенциала при кислотно-основном титровании тем больше, чем больше концентрация титруемой кислоты или щелочи и чем больше их степень диссоциации. Минимальные концентрации удовлетворительно титруемых кислот и оснований следующие:
· константа диссоциации;
· кислоты - 10-7 до 5·10-7 до10-6 до10-5;
· концентрация, г-экв/л - не титруется 1 0,1 0,001.
Поскольку ход кривой потенциометрического титрования зависит от константы диссоциации, то можно титровать смесь кислот, отличающихся значениями Kg (рис.21, кривая 1).
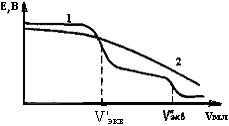
Рис.21. Кривые титрования смеси сильной (1) и слабой (2) кислоты
В этом случае на кривой титрования получается два скачка потенциала: сначала оттитровывается сильная кислота (эквивалентная точка V'экв) а затем слабая (V''экв). Для того, чтобы при титровании смеси кислот получались четкие кривые титрования, необходимо, чтобы значения Кg этих кислот отличались не менее чем на четыре порядка:
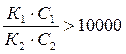 . (23)
. (23)
В противном случае на кривой потенциометрического титрования может не получиться четко выраженных скачков потенциала (рис.21. кривая 2), Необходимо отметить, что отсутствие ярко выраженного скачка потенциала у кривой титрования в координатах Е; В-V, мл еще не означает, что эквивалентную точку определить нельзя. Необходимо построить дифференциальную кривую титрования в координатах 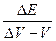 мл, что для ряда случаев позволит получить значения эквивалентной точки.
мл, что для ряда случаев позволит получить значения эквивалентной точки.
2.1.2.3. Титрование в неводных, растворителях. В потенциометрическом титровании довольно широко применяются также неводные растворители. По способности отдавать или принимать протоны неводные растворители можно разделить на четыре группы:
- растворители, проявляющие только кислотные свойства, например, ледяная уксусная кислота;
- растворители, проявляющие только основные свойства, например, жидкий аммиак;
- амфипротонные растворители, проявляющие как кислотные, так и основные свойства, например, этанол;
- апротоннке растворители, не проявляющие ни кислотных, ни основных свойств, например, бензол и четыреххлористый углерод.
Применение неводных растворителей дает возможность проводить потенциометрическое титрование таких веществ, титрование которых в водном растворе осуществляется с трудом или вообще невозможно, (например, веществ, не растворимых в воде или образующих стойкие эмульсии и суспензии). Хороший результат можно получить и при титровании смесей кислот или оснований, которые не титруются раздельно в водном растворе. Так, при титровании смеси хлористоводородной и монохлоруксусной кислот в водном растворе гидроксидом натрия скачки потенциалов, соответствующие эквивалентным точкам, определить трудно (рис.22, кривая 1).
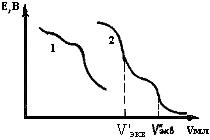
Рис.22. Кривые потенциометрического титрования в различных растворителях: 1- вода; 2- ацетон
Если в качестве растворителя взять ацетон, то получается кривая с четко выраженными скачками потенциала, по которым можно точно определить эквивалентные точки для обеих кислот (V´экв и V"экв).
Как известно, при производстве сульфатной целлюлозы основным отходом производства является черный сульфатный щелок. Из него в дальнейшем выделяют сульфатное мыло, из которого получают талловое масло - сырье для получения талловой канифоли и синтетических моющих средств. Таловое масло в основном (92%) состоит из жирных (олеиновой, линоленовой, стеариновой и т.д.) и смоляных (абиетиновой) кислот, которые не растворимы в воде. Определение их содержания проводят методом экстракции. Однако этот метод является весьма длительным (анализ длится почти двое суток) и многооперационным. В связи с этим явный интерес представляет потенциометрическое титрование жирных и смоляных кислот в неводных растворителях - этаноле или бутаноле - гидроксидом натрия. При этом получаются типичные кривые потенциометрического титрования (индикаторным электродом является стеклянный электрод, электродом сравнения - хлорсеребряный). Описанный метод обладает достаточной точностью, а время проведения опыта составляет 10-15 минут.
2.1.2.4. Способы нахождения конечной точки титрования. Основной задачей при потенциометрическом титровании является обнаружение скачка потенциала, отвечающего конечной точке титрования, и нахождение эквивалентной точки. Для этого применяют два способа - расчетный и графический.
Расчетный способ. Кривые титрования можно построить на основании расчетных величин потенциала в зависимости от концентрации раствора, а потенциал в точке эквивалентности рассчитать на основании типа реакции. Этот случай рассматривать не будем, т.к. в практических работах используется графический способ нахождения конечной точки титрования.
Графический способ. Строится кривая потенциометрического титрования в координатах «ЭДС гальванического элемента (или потенциал индикаторного электрода) - объем прибавленного титранта». На рис.23,а приведена интегральная кривая потенциометрического титрования. Для нахождения конечной точки титрования проводят две параллельные касательные к пологим нижней и верхней ветвям кривой. Третью касательную проводят к восходящей (или нисходящей) части кривой до пересечения с двумя первыми касательными) (см. рис. 23,а). Полученный отрезок прямой m n делят пополам и получают конечную точку титрования А (эквивалентную точку). Опуская из точки перпендикуляр к оси абсцисс, получают эквивалентный объем титранта Vэкв.
Более точным способом нахождения конечной точки титрования А является построение дифференциальной кривой потенциометрического титрования в координатах 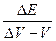 мл (рис.23,б), где
мл (рис.23,б), где 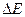 - разность между вторым и первым значением ЭДС. между третьим и вторым и т.д. В этом случае максимум на кривой соответствует конечной точке титрования. При титровании смеси кислот различной силы на кривой титрования появится несколько максимумов.
- разность между вторым и первым значением ЭДС. между третьим и вторым и т.д. В этом случае максимум на кривой соответствует конечной точке титрования. При титровании смеси кислот различной силы на кривой титрования появится несколько максимумов.
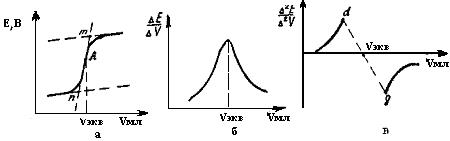
Рис.23. Различные графические способы нахождения конечной точки при потенциометрическом титровании
В ряде случаев, когда конечную точку титрования надо зафиксировать наиболее точно, ее находят по кривой зависимости 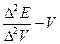 , мл (рис.23,в). Для этого соединяют концы обеих ветвей кривой, которые находятся с разных сторон оси абсцисс (прямая dg). Точка пересечения прямой dgс осью абсцисс дает объем титранта, соответствующий конечной точке титрования.
, мл (рис.23,в). Для этого соединяют концы обеих ветвей кривой, которые находятся с разных сторон оси абсцисс (прямая dg). Точка пересечения прямой dgс осью абсцисс дает объем титранта, соответствующий конечной точке титрования.
Ранее отмечалось, что при кислотно-основном титровании потенциал индикаторного электрода зависит от рН исследуемого раствора (уравнение II). Поэтому кривые окислительно-восстановительного титрования часто строят в координатах 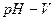 , мл;
, мл; 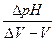 , мл;
, мл; 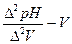 , мл.
, мл.
2.1.3. Аппаратура. В потенциометрии различают два вида измерительных приборов:
- потенциометры, работающие по компенсационной схеме;
- высокоомные вольтметры. Рассмотрим принцип компенсационного метода. Компенсационный метод определения ЭДС, иногда называемый методом Поггендорфа, заключается в следующем (рис.24). При замыкании ключа 1 от источника постоянного тока 2 на реохорд 4 подается некоторое напряжение, регулируемое переменным сопротивлением 3. На реохорде 4 напряжение равномерно повышается от нуля до значения ЭДС источника тока (например, аккумулятора). Нормальный элемент Вестона 6, ЭДС которого постоянна и равна 1,0186 В при 25оС, через ключ 8 и гальванометр 10 присоединен одним концом к движку реохорда II, а другим - к началу реохорда. Параллельно нормальному элементу Вестона подключена электролитическая ячейка 7, состоящая из индикаторного электрода и электрода сравнения, ЭДС которой нужно определить.

Рис.24. Схема установки для измерения ЭДС гальванических элементов компенсационным способом
Сомкнув ключи 1 и 8, мы навстречу ЭДС аккумулятора 2включаем ЭДС нормального элемента Вестона и, передвигая подвижной контакт реохорда 4, добиваемся компенсация, т.е. ЭДС аккумулятора, скомпенсированная сопротивлением реохорда 4, становится равной ЭДС нормального элемента Вестона (стрелка гальванометра в этот момент должна стоять на нулевой отметке). В этот момент ЭДС реохорда равна ЭДС нормального элемента Вестона:
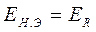 . (24)
. (24)
Известно, что
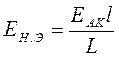 , (25)
, (25)
где
ЕАК - ЭДС аккумулятора;
l- отрезок реохорда от положения движка;
L - общая длина реохорда.
Тогда, учитывая равенство электродвижущих сил, имеем
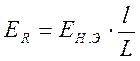 . (26)
. (26)
Таким образом, мы узнали цену деления реохорда. Далее, отключим контакт 8 и замкнем контакт 9. В этом случае навстречу проградуированной ЭДС источника тока включена ЭДС гальванического элемента 9, которую нужно определить. Точно так же, передвигая контакт 11, добиваемся момента компенсации (стрелка гальванометра должна стоять на нулевой отметке). Поскольку цена деления реохорда известна, определяем ЭДС гальванического элемента:
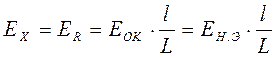 . (27)
. (27)
Принципиальная схема потенциометра, работающего по компенсационной схеме, представлена на рис.25. в настоящее время промышленностью выпускаются высокоомные потенциометры типа ППТВ-1.Р-300, Р-307 и другие.
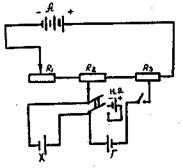
Рис.25. Схема типового потенциометра:
А. - аккумулятор;
R1, R2, R3, - набор сопротивлений;
н.э.- нормальный элемент Вестона;
х - исследуемый гальванический элемент;
Г – гальванометр.
Устройства, измеряющие ЭДC по некомпеасационной схеме, называются высокоомными вольтметрами. Это, например, рH-метры (ионометры), шкала которых проградуирована в милливольтах (мВ) и рХ. Таким образом, эти приборы могут работать как милливольтметры и рХ-метры, Другими словами, при потенциометрическом титровании можно строить кривые в координатах Е,В - V, мл; 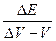 , мл; или рХ - V, мл; или
, мл; или рХ - V, мл; или 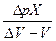 , мл (естественно, что, если проводится кислотно-основное титрование, то кривые строятся в координатах pH-V, мл); или
, мл (естественно, что, если проводится кислотно-основное титрование, то кривые строятся в координатах pH-V, мл); или 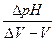 мл.
мл.
В настоящее время промышленностью выпускаются рН-метры рH-121, рН-340, рН-673, ЭВ-74 и другие.
Кроме того, выпускаются вольтметры прямого отсчета, снабженные электронным усилителем для получения сигнала, который регистрируется с помощью цифрового счетчика (Щ-1413; Щ-4313; И-120). Вольтметры прямого отсчета выпускаются также с измерительным устройством, шкала которого проградуирована в единицах рН и милливольтax.
Приборы типа высокоомного вольтметра дают менее высокую точность, нежели приборы, работающие по компенсационной схеме. Однако рН-метры проще в эксплуатации и незаменимы в работе с автоматическими титраторами.
Из электродов сравнения наиболее широко применяется хлорсеребряный электрод, поскольку он, в отличие от каломельного электрода сравнения, не имеет в своем составе ртути. В настоящее время выпускаются хлорсеребряные электроды сравнения ЭВЛ-1М3, ЭВЛ-1M1 и т.п.
Применение в потенциометрии того или иного индикаторного электрода зависит от ряда условий:
- применяемого титрования;
- определяемого элемента;
- наличия примесей в растворе;
- концентрации раствора.
Обычно стараются применить наиболее стойкий и чувствительный в данных условиях электрод.
Металлические индикаторные электроды изготовляют из плоской металлической пластинки, скрученной проволоки и т.п. Отечественная промышленность выпускает тонкослойный платиновый электрод ЭТПЛ-1, а также проволочный платиновый электрод ЭПЛ-1. Все более широко отечественной промышленностью выпускаются ионоселективные электроды:
-стеклянные электроды для определения рН: ЭСП-11Г-05; ЭСЛ-41Г-04; ЭСЛ-63-07;
Дата добавления: 2015-07-21; просмотров: 327 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА. 1 страница | | | ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА. 3 страница |