
|
Читайте также: |
- стеклянные электроды для измерения активности ионов Na+ (ЭС A-51-07) и ионов К+ (ЭСЛ-91-07);
- пленочные пластифицированные электроды ЭМ-С1O4-О1; ЭМ-NO3-O1.
В заключение следует отметить, что метод потенциометрии незаменим в тех случаях, когда те или иные измерения необходимо проводить в условиях отсутствия электрического тока (приборы не к чему подключать). Действительно, имея небольшой переносной потенциометр компенсационного типа, портативный аккумулятор, элемент Вестона и набор электродов, можно проводить анализы в походах, экспедициях и т.п.
2.2. Вольтамперометрия. Только что рассмотренный метод потенциометрического анализа основан на электродных реакциях в отсутствие внешнего тока (ток во внешней цепи появляется за счет работы гальванического элемента). В противоположность этому вольтамперометрия основана на электродных реакциях, протекающих за счет приложенного извне постоянного электрического тока.
2.2.1. Явления на электродах электрохимической ячейки при прохождении постоянного электрического тока. Ранее отмечалось, что при пропускании тока через электрохимическую ячейку перенос электричества осуществляется:
- по металлическим проводам и электродам - за счет направленного перемещения электронов;
- в растворе электролита - вследствие миграции ионов. При этом положительно заряженные ионы (катионы) движутся к отрицательно заряженному электроду (катоду), а отрицательно заряженные ионы (анионы) перемещаются к положительно заряженному электроду (аноду);
- через межфазную границу «электрод-электролит» - за счет электродных окислительно-восстановительных реакций.
Напомним кратко, какие электродные процессы происходят в электрохимической ячейке, заполненной водным раствором ZnCl2, в который опущены цинковый и платиновый электрода, при прохождении постоянного электричества тока (рис. 26). В растворе электролита ионы цинка и хлора движутся хаотично. Однако если мы подключим цинковый электрод к отрицательному полюсу источника тока, а платиновый электрод - к положительному полюсу, то катионы начнут перемещаться к катоду, а анионы к аноду. Если, мы приложим к электродам ячейки необходимую разность потенциалов, на катоде начнется выделение металлического цинка:
Zn2+ + 2e Þ Zn0
на нерастворимом аноде будет выделяться хлор:
2Cl- - 2e Þ Cl2
В зависимости от природы электролита и материала электродов на последних не обязательно выделяются продукты растворенной соли. Например, при электролизе раствора Nа2SO4 на катоде будет выделяться водород:
2H2O + 2e = H2 + 2OH-
а на аноде кислород;
2H2O - 4e = O2 + 4H+
Это происходит потому, что для разряда каждого вида иона на электроде должен быть достигнут потенциал его выделения. В последнем случае потенциалы выделения ионов Na+ и S042- не достигнуты, поэтому они на электродах не выделяется.
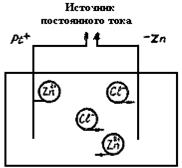
Рис.26. Электрохимическая ячейка
Могут быть и другие случаи. Например, при электролизе FeCl3 на катоде получается двухвалентное железо Fe3++e Fez+, которое на аноде вновь может окисляться до трехвалентного состояния:
Fe2+ - e Þ Fe3+
Однако всегда на катоде электроны переходят от электрода к ионам, а на аноде - от ионов к электроду. Для прохождения постоянного тока через ячейку (т.е. чтобы на электродах происходили электродные реакции) на ее электроды нужно подавать необходимое напряжение, определяемое по формуле
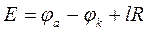 , (28)
, (28)
где
Е - напряжение на клеммах ячейки, В;
φa - электродный потенциал анода, В;
φк - электродный потенциал катода, В;
iR падение напряжения в электролите между электродами, В.
Практически же получается, что к электродам ячейки необходимо приложить большее напряжение, нежели рассчитанное по (28), т.к. в действительности происходит поляризация электродов.
Рассмотрим это на примере. Возьмем электрохимическую ячейку, заполненную электролитом, и на ее электроды подадим напряжение от источника постоянного тока (рис.27).
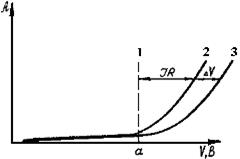
Рис.27. Вольтамперные кривые
Вначале при увеличении напряжения на клеммах электрохимической ячейки сила тока может быть практически равна нулю. Это происходит потому, что не достигнуты потенциалы выделения данных веществ, следовательно, они не выделяются на электродах за счет окислительно-восстановительных электродных реакций (электрическая цепь разомкнута, т.к. ток не проходит через межфазную границу «электрод-электролит»). Но как только при дальнейшем увеличении напряжения будут достигнуты потенциалы выделения веществ (см. рис. 27. точку a), на электродах начнут происходить электродные реакции и, согласно закону Ома, дальнейшее увеличение напряжения повлечет за собой возрастание силы тока. Если бы сопротивление электролита в ячейке равнялось нулю, то с повышением напряжения сила тока возрастала бы по линии 1. Поскольку же раствор электролита обладает определенным сопротивлением, вследствие чего в нем происходит падение напряжения (iR), сила тока с повышением напряжения на клеммах ячейка, в соответствии с уравнением (28), должна бы повышаться по кривой 2 (см. рис.27). В действительности, снимая подобную зависимость, мы получаем кривую 3. Таким образом, реальный ход i-V кривой будет отличаться от расчетного на величину ΔV. Это приращение напряжения получило название поляризации, или перенапряжения. Поскольку напряжение на клеммах электрохимической ячейки складывается, помимо падения напряжения в электролите, из электродных потенциалов катода и анода, это означает, что электродные потенциалы выделения веществ на катоде и аноде несколько превышают их равновесные потенциалы. При этом потенциал катода смещается в область отрицательных значений, потенциал анода - в область положительных значений. Например, по расчету потенциал выделения вещества на катоде равен 0,5 В, на анода 0,8 В. Их алгебраическая сумма Е=0,8-(-0,5)=1,3 В. В действительности из-за поляризационных явлений электродный потенциал катода смещен в область отрицательных значений на 0,2 В и равен -0,7 В; электродный потенциал анода сместился в область положительных значений на 0,1 В и стал равен 0,9 В. Тогда их алгебраическая сумма будет равна:
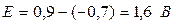 , т.е. > Е на 0,3 В.
, т.е. > Е на 0,3 В.
Различают концентрационную поляризацию (или перенапряжение диффузии), химическую поляризацию (перенапряжение реакции), кристаллизационную поляризацию (перенапряжение кристаллизации). Следует отметить, что последний вид поляризации - перенапряжение кристаллизации открыт свердловским ученым, профессором Уральского политехнического института О. Н. Есиным. Как известно, любая электрохимическая реакция многостадийна. Например, реакция выделения ионов меди состоит из трех стадий.
1. Подход ионов меди из глубины электролита к поверхности катода.
2. Собственно акт электрохимического превращения: Сu2+ + 2е →Сu0.
3. Внедрение атома меда в кристаллическую решетку катода.
В случае выделения газов стадий реакции может быть больше. Например, при выделении водорода различают пять стадий.
1. Подход ионов водорода к катоду.
2. Собственно электрохимическое превращение: Н+ + е →Н
3. Образование молекулы водорода: Н + Н → Н2
4. Объединение молекул в пузырьки газа.
5. Отрыв пузырьков от поверхности катода.
Известно, что скорость сложной многостадийной химической реакции определяется скоростью ее наиболее замедленной стадии. Подобным образом определяется, какой вид поляризации присущ данному электрохимическому процессу.
Если наиболее замедленной стадией электрохимической реакции является диффузия ионов из глубины электролита к поверхности катода, мы имеем дело с концентрационной поляризацией или, как ее еще называют, перенапряжением диффузии.
В случае если наиболее замедленной стадией электрохимической реакции является собственно электрохимическое превращение (а в случае выделения, например, газов - также стадия рекомбинации или образования пузырьков газа), мы имеем дело с химической поляризацией (или перенапряжением реакции).
Наконец, если наиболее замедленной стадией является вхождение разрядившихся ионов в кристаллическую, решетку металла, мы имеем дело с кристаллизационной поляризацией или перенапряжением кристаллизации.
Несмотря на различные виды поляризации, необходимо подчеркнуть, что во всех случаях их реальная сущность заключается в приращении потенциала катода при смещении его в область отрицательных значений, равно как и в смещении потенциала анода в область положительных значений. В конечном итоге происходит увеличение напряжения, приложенного к клеммам электрохимической ячейки. Таким образом, при прохождении через электрохимическую ячейку постоянного тока уравнение (28) следует записать в следующем виде:
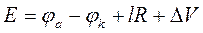 , (29)
, (29)
где ΔV - дополнительное напряжение на клеммах ячейки вследствие поляризационных явлений на катоде и аноде.
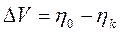 , (30)
, (30)
где
ηа - поляризация (перенапряжение) анода;
ηK - поляризация (перенапряжение) катода.
2.2.2. Теоретические основы метода. Вольтамперометрический метод анализа основан на использовании явления поляризации микроэлектрода, получении и обработке вольтамперных (поляризационных) кривых, отражающих зависимость силы тока от приложенного напряжения. Таким образом, аналитическим сигналом для количественного анализа в данном методе является сила тока, которая зависит от концентрации раствора электролита.
В вольтамперометрии используют два электрода: рабочий поляризуемый электрод с малой поверхностью и неполяриэуемый электрод сравнения. Если, в качестве рабочего электрода выбран электрод с постоянно обновляющейся поверхностью (например, ртутный капающий электрод), то метод анализа называют полярографическим. В случае применения в качестве рабочего электрода таких металлов, как Pt, Fе и т.п., мы имеем дело собственно с вольтамперометрией.
При прохождении тока через электролитическую ячейку напряжение, приложенное к ее клеммам, согласно формуле 29, равно:
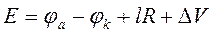 . (31)
. (31)
Если определяемое вещество способно восстанавливаться при прохождении тока через его раствор в ячейке, то рабочий электрод с малой поверхностью делают катодом; если вещество окисляется - малый электрод делают анодом.
Предположим, что рабочим электродом с малой поверхностью является катод. Сделаем следующее. Добавим к исследуемому раствору «фон» - раствор сильного электролита, хорошо проводящего ток, с концентрацией в 100-1000 раз большей, чем раствор исследуемого вещества. Движение ионов к катоду или аноду происходит под действием двух сил:
- силы диффузии, обусловленной наличием разности концентраций ионов вещества в прикатодном слое и в глубине электролита;
- электролитической силы (движение ионов под действием этой силы называется миграцией).
Ионы фонового электролита являются электрохимически индифферентными, так как не принимают участия в электродных реакциях. Катионы фона (или анионы, в зависимости от того, какой знак имеет рабочий микроэлектрод), двигаясь к катоду, не могут при данном потенциале на нем разряжаться и остаются у поверхности электрода, образуя двойной электрический слой. Электрическое поле катода экранируется этими ионами, и поэтому катионы анализируемого вещества не притягиваются данным полем и двигаются только за счет силы диффузии.
Кроме того, введение фона увеличивает электропроводность электролита, и сопротивление его в ячейке становится весьма небольшим (R ~ 1 кОм). А так как сила тока в вольтамперометрии не превышает 10-5 А, то падением напряжения в электролите iR можно пренебречь. В результате уравнение (23) принимает вид:
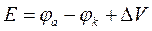 . (32)
. (32)
Далее, поверхность вспомогательного электрода (в нашем случае - анода) сделаем в сотни раз больше, чем поверхность рабочего микроэлектрода. Поскольку сила тока в вольтамперометрии мала, а поверхность анода велика, последний не будет поляризоваться при изменении силы тока, φa будет оставаться постоянным. Аналогичный вывод можно сделать и тогда, когда в качестве вспомогательного электрода используется каломельный электрод сравнения |Hg2Cl2, КСlнас|Нg. Действительно, каломельный электрод изготовлен на основе металлической ртути и твердого хлорида ртути Hg2Cl2, находящегося в равновесии с водным раствором хлорида калия (см. рис.8). Если такой электрод является анодом, то процесс на нем заключается в том, что атомы ртути отдают электроны, причем ионы ртути образуют с ионами хлора, находящимися в растворе, осадок каломели:
2Нg+2Сl- = Нg2Cl2+2е
Потенциал ртутного анода определяется концентрацией ионов ртути в растворе:
 . (33)
. (33)
Концентрации Нg22+ в свою очередь определяются концентрацией ионов Cl-:
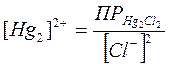 . (34)
. (34)
Поскольку плотность тока на аноде мала, то концентрация ионов Сl- вблизи анода изменяется настолько мало, что практически не влияет на концентрацию ионов Hg22+. Вследствие этого анод не поляризуется и его потенциал практически не меняется.
Итак, потенциал анода  в уравнении (32) остается практически постоянным, следовательно, не влияет на величину
в уравнении (32) остается практически постоянным, следовательно, не влияет на величину 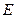 . Тогда уравнение (16) принимает вид
. Тогда уравнение (16) принимает вид
 . (35)
. (35)
Таким образом, величина напряжения, приложенного к электролитической ячейке, определяется изменением потенциала катода, который мы избрали в качестве рабочего микроэлектрода. Ясно, что если рабочий микроэлектрод является анодом, то
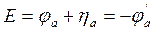 . (36)
. (36)
На рис.28,а приведена полярографическая установка, электролитическая ячейка которой имеет капающий катод 1 (рабочий микроэлектрод); вспомогательным электродом 2 (анодом), имеющим большую поверхность, является ртуть, налитая на дно ячейки, которая через платиновую проволоку соединяется с полярографом 4. В этом случае поляризоваться будет только рабочий микрокатод (капля ртути, втекающая из капилляра) и, естественно, только на нем возможен электрохимический процесс восстановления. Ячейка имеет трубки 3 для пропускания азота, чтобы удалить из ячейки растворенный кислород. На ртутном капающем катоде происходит процесс:
Men++ne Me (амальгама)
Образовавшийся свободный металл диффундирует в глубь капли ртути. Затем капля амальгамы падает, и процесс начинается на новой капле ртути.

Рис.28. Полярографические установки
На рис.28,б показана полярографическая установка, у ячейки которой вспомогательным электродом служит каломельный электрод сравнения 2, соединенный с исследуемым раствором, либо электролитическим ключом 5, либо стеклянной пористой пластинкой. Ячейки, представленные на рис.28, а, б являются простейшими.
На рис.28,в показана полярографическая установка с твердыми электродами (1 и 2). Если мы будем непрерывно увеличивать напряжение, подводимое к электродам ячейки, то будет возрастать потенциал рабочего микроэлектрода. Измерив силу тока, проходящего через ячейку, и построив зависимость силы тока i от потенциала V, получим кривую, называемую полярографической волной (рис.29).
При малых значениях потенциала ионы анализируемого вещества не разряжаются на микроэлектроде, т.к. потенциал их разряда еще не достигнут. Небольшой ток на участке 1 обусловлен разрядом более положительных, чем ионы анализируемого вещества, примесей и называется остаточным током. При дальнейшем увеличении напряжения на клеммах ячейки достигается потенциал разряда исследуемых ионов 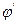 , которые начинают разряжаться на рабочем микроэлектроде. В результате этого ток резко возрастает (участок II). Это так называемый фарадеевсний ток. Он увеличивается до некоторого предельного значения, и с дальнейшим ростом потенциала его значение практически остается постоянным (участок III). Возникает предельный ток диффузии (iпред.диф).
, которые начинают разряжаться на рабочем микроэлектроде. В результате этого ток резко возрастает (участок II). Это так называемый фарадеевсний ток. Он увеличивается до некоторого предельного значения, и с дальнейшим ростом потенциала его значение практически остается постоянным (участок III). Возникает предельный ток диффузии (iпред.диф).
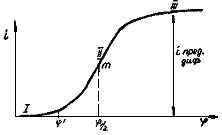
Рис.29. Полярографическая волна
Постоянство iпред.диф обусловлено тем, что в данной области потенциалов число ионов анализируемого вещества, продиффундировавших из глубины раствора электролита к поверхности рабочего микроэлектрода, равно их количеству, разрядившемуся на нем. Таким образом, скорость диффузии в этих условиях контролирует скорость электрохимического процесса в целом. Следовательно, величина предельного тока диффузии будет пропорциональна концентрации анализируемых ионов, вступивших в электрохимическую реакцию на рабочем микроэлектроде.
Полярографическая волна (или полярограмма) содержит ценную аналитическую информацию. Для этого на полярограмме необходимо определить величину потенциала полуволны 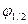 и значение iпред.диф.
и значение iпред.диф.
Потенциалом полуволны 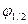 называется потенциал середины полярографической волны (точка m). Потенциал полуволны не зависит от концентрации анализируемых ионов, а зависит только от их природы. Таким образом, величина φ1/2 служит качественной характеристикой полярографически активного вещества, поскольку каждый ион имеет свой постоянный потенциал полуволны. В справочниках имеются значения потенциалов полуволны. Поэтому, определив из подпрограммы величину
называется потенциал середины полярографической волны (точка m). Потенциал полуволны не зависит от концентрации анализируемых ионов, а зависит только от их природы. Таким образом, величина φ1/2 служит качественной характеристикой полярографически активного вещества, поскольку каждый ион имеет свой постоянный потенциал полуволны. В справочниках имеются значения потенциалов полуволны. Поэтому, определив из подпрограммы величину 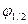 , по табличным данным можно найти, ионы какого вещества участвуют в электрохимической реакции на рабочем микроэлектроде.
, по табличным данным можно найти, ионы какого вещества участвуют в электрохимической реакции на рабочем микроэлектроде.
Зависимость предельного тока диффузии при использовании ртутного капающего электрода выражается уравнением Ильковича:
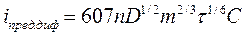 , (37)
, (37)
где
n - заряд иона, разряжающегося на микроэлектроде;
D - коэффициент диффузии, см2с-1;
m - масса ртути, вытекающая из капилляра за секунду;
τ - время жизни ртутной капли, с;
С - объемная концентрация исследуемых ионов, моль-л-1.
Для определенного иона и капилляра с постоянной характеристикой все величины правой части уравнения (37) постоянны, тогда:
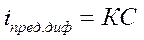 . (38)
. (38)
Следовательно, определив из полярограммы величину iпред.диф, рассчитывают концентрацию анализируемого вещества.
Для твердого микроэлектрода уравнение зависимости iпред.диф от концентрации исследуемых ионов имеет вид
 , (39)
, (39)
где
S - площадь микроэлектрода, см2;
δ - толщина диффузионного слоя, см;
F - число Фарадея, Кл.
Таким образом, по величине потенциала полуволны можно провести качественный анализ исследуемого раствора, а по значению предельного тока диффузии - количественный анализ (определить концентрацию раствора).
Если раствор электролита содержит ионы нескольких веществ, способных, например, восстанавливаться на рабочем микрокатоде, полярограмма может иметь несколько волн (рис.30). Определив из полярограммы величину φ´1/2 φ´´1/2, φ´´´1/2, по таблицам идентифицируем вещества, которые присутствуют в исследуемом растворе, а по найденным значениям iпред.диф находим их концентрацию. Чтобы полярографические волны не сливались, необходимо, чтобы потенциалы разряда определяемых ионов отличались не менее чем на 100-150 мВ. Полярографические измерения на ртутном капающем электроде могут быть использованы для определения концентрации веществ от 0,2 до -1,9 В. Однако работа с таким электродом требует тщательного соблюдения всех мер, предусмотренных правилами техники безопасности при работе со ртутью.
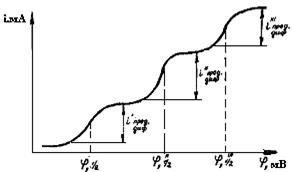
Рис.30. Полярограмма раствора, содержащего несколько ионов, разряжающихся на микроэлектроде
Твердые электроды более удобны и безопасны, однако область их использования пока ограничена.
Остановимся еще на одном важном явлении, которое встречается при полярографии - возникновении максимумов на полярографических кривых.
В ряде случаев вместо нормального хода полярограммы получается кривая с максимумом. Это происходит вследствие того, что в некотором интервале потенциалов возникает ток, превышающий предельный ток диффузии (рис.31).
В этом случае определение величины iпред.диф (иногда говорят «определение высоты полярографической волны») становится невозможным.
Максимумы первого рода появляются при отсутствии поверхностно-активных веществ (ПАВ) на фоне слабоконцентрированных электролитов и имеют форму пика (см. рис.31,а).
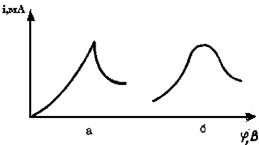
Рис.31. Максимумы на полярографических кривых:
а- максимум первого рода; б- максимум второго рода
Это объясняется движением поверхности ртутной капли, вызывающей дополнительное перемешивание раствора, что увеличивает доставку ионов к рабочему микроэлеитроду и, следовательно, увеличивает силу диффузионного тока.
Максимумы второго рода появляются в концентрированных растворах при работе с быстро капающим ртутным электродом и имеют более сглаженную форму (см. рис.31,б). Они объясняются движением внутри самой ртутной капли, вызываемым вытеканием ртути из капилляра. В результате этого процесса происходит перемешивание раствора, вследствие чего увеличивается диффузионный ток.
Естественно, что для проведения полярографического анализа от максимумов нужно избавляться. Максимумы первого и второго рода могут быть сведены на нет добавкой ПАВ, тормозящих движение поверхности ртути (рис.32). В качестве таких ПАВ применяют желатин, агар-агар, столярный клей и т.п.
2.2.3. Методы вольтамперометрического анализа. Основной задачей вольтамперометрического анализа является качественный и количественный анализ исследуемого раствора. Если качественный анализ по потенциалу полуволны затруднений не вызывает, то для, проведения количественного анализа по величине iпред.диф существует ряд методов.
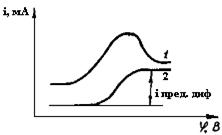
Рис.32. Полярографические кривые:
1- с максимумом второго рода; 2 - та же кривая с добавкой ПАВ
Метод расчета. Заключается в том, что с помощью полученной полярограммы измеряют величину iпред.диф а также определяют массу ртути m и время образования капли τ (значения коэффициента диффузии D берут из таблиц). Затем по уравнению Ильковича (37) определяют концентрацию анализируемого вещества:
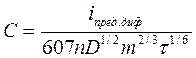 . (40)
. (40)
Этот метод интересен с теоретической точки зрения, но применяется редко.
Метод калибровочных кривых. Готовят ряд эталонных растворов определяемого вещества, концентрация которых точно известна. Строят калибровочный график (рис.33) в координатах «h – С», где h - высота вольтамперометрической кривой, равная величине iпред.диф; С - концентрация, моль·л-1. Затем снимают вольтамперную кривую исследуемого раствора и, определив ее высоту h,находят по калибровочному графику концентрацию анализируемого раствора Сх.
Метод стандарта. Готовят один эталонный раствор, снимают его вольтамперную кривую и такую же кривую для анализируемого раствора. Зная концентрацию стандартного раствора (С ст) и определив высоту стандартного (hст) и анализируемого (hx) растворов, можно рассчитать концентрацию определяемого вещества по формуле
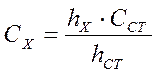 . (41)
. (41)
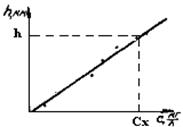
Рис.33. Калибровочный график
Метод добавок. вначале снимают вольтамперную кривую анализируемого раствора, затем в ячейку прибавляют по каплям стандартный раствор, определяемого иона с точно известной концентрацией с таким расчетом, чтобы высота волны возросла вдвое. Снимает вольтамперную кривую полученного раствора и делают расчет по формулам
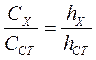 ,
,
где
Сх - концентрация анализируемого иона, мг/л;
hx - высота волны анализируемого иона,мм;
Сст - концентрация добавляемого иона, мг/л;
hCT - высота волны стандартного раствора, мм;
hобщ - суммарная высота определяемого вещества в анализируемом и прибавляемом растворах, мм.
Концентрацию определяемого иона, введенного в ячейку в виде стандартного раствора, вычисляют по формуле:
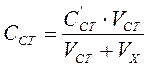 , (42)
, (42)
где
Сст - первоначальная концентрация стандартного раствора, мг/л;
VCT - количество стандартного раствора, добавленного в ячейку, мл;
Vx - объем анализируемого раствора в ячейке, мл.
2.2.4. Новые направления в вольтамперометрии. Чувствительность классического метода вольтампероматрии во многих случаях бывает явно недостаточной.
Новые отрасли науки и техники предъявляют особые требования, например, к чистоте материалов и, соответственно, к методам их контроля. В связи с этим возникла необходимость разработки методов, позволяющих определять примеси при содержаний их в анализируемом веществе до 10-5–10-7 %. Так появились другие разновидности вольтамперометрического анализа, которым свойственна повышенная селективность, большая чувствительность, лучшая воспроизводимость. Кратко рассмотрим важнейшие из них.
Вольтамперометрия с линейной разверткой потенциала. Сущность данного способа анализа заключается в том, что напряжение на микроэлектрод и вспомогательный электрод подается со скоростью изменения до 100 В/с, а получаемая вольтамперная кривая регистрируется на осциллографе. Это дает возможность изучать процессы, мгновенно протекающие на микроэлектроде (до 10-7 с), а также повышает чувствительность метода, поскольку imax на осциллограммах в несколько раз больше iпред.диф получаемого на полярограммах.
Значительно большие, чем в классическом методе вольтамперометрии, скорости изменения поляризующего напряжения приводят к изменению формы вольтамперной кривой (рис,34,а): вместо полярографической волны наблюдается кривая с четко выраженным максимумом (пиком). Потенциал максимума φmax используется для качественного анализа вещества в растворе, т.е. он характеризует природу вещества. Максимальная высота h пика, соответствующая iпред.дифпропорциональна концентрации вещества, окисляющегося или восстанавливающегося на микроэлектроде, и используется для количественного анализа. Определив высоту пика, концентрацию вещества в растворе рассчитывают по формуле
Дата добавления: 2015-07-21; просмотров: 90 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА. 2 страница | | | ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА. 4 страница |