
Читайте также:
|
Диазосоединения ароматического ряда получают взаимодействием первичного ароматическог амина с азотистой кислотой.В общем виде эта реакция может быть представлена следующей схемой:
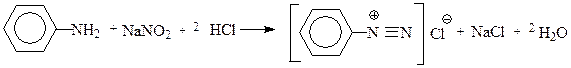 |
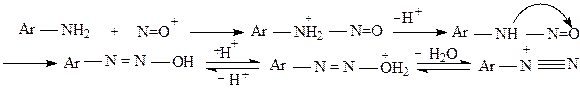 |
Диазотирование ароматических аминов проводится в водной среде в присутствии 2-3 молей минеральной кислоты притемпературе ниже нуля грудусов.Первичный амин вступает в реакцию в свободном состоянии, но так как реакция проводится в кислой среде, то амин присутствует в виде соли:
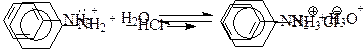 |
По мере диазотирования, равновесие смещается вправо, в сторону образования свободного амина. Минеральная кислота выполняет несколько функций:растворяет амин, образует азотистую кислоту из нитритов, образует активный нитрозирующий агент. Ее избыток приводит к уменьшению концентрации свободного амина, ее недостаток способствует протеканию побочной реакции – образованию диазоаминосоединений:
 |
Для предотвращения этой побочной реакции диазотирование ведут с такой скоростью, чтобы в растворе не было избытка свободного амина и постоянно присутствовал диазотирующий агент.Наиболее оптимальные условия диазотирования, как уже было сказано, 2-3 моля кислоты на 1 моль амина.Реакция диазотирования эндотермична, поэтому перед началом реакции растворы амина и нитрита натрия охлаждают, а при проведении ее держат реакционную смесь в кристаллизаторе со льдом и даже прибавляют лед в реакционную массу,постоянно следя за температурой.Охлаждение предотвращает течение еще одной побочной реакции -разрушение соли диазония до фенолов.Оптимальная температура диазотирования - ниже 0 С. Номенклатура солей диазония.
Для названия соли диазония добавляется окончание диазоний к названию ароматического радикала с указанием названия анионаНапример:
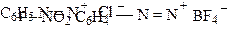 |
п-нитрофенилдиазонийборфторид, борфторид п-нитрофенилдиазония.
Соли диазония - это ионные соединения,легко растворимые в воде, существуют, в основном,из-за своей крайней неустойчивости, в растворе при низких температурах. При повышении температуры легко распадаются с выделением азота, хотя есть и исключения. Так,например, борфторид фенилдиазония выделен в твердом состоянии. В связи с этим соли арилдиазониев не выделяют, а применяют их относительно безопасные водные растворы, получаемые при диазотировании первичных ароматических аминов. Относительную стабильность ароматических солей диазония (в противоположность алкилдиазониевым ионам, спонтанно разлагающимся даже при низких температурах) объясняют делокализацией положительного заряда по ароматическому ядру. Соли диазония легко вступают в реакции с отщеплением молекулярного азота, причем отрыв молекулы азота может происходить (в зависимости от условий) как гетеролитически, так и гомолитически:
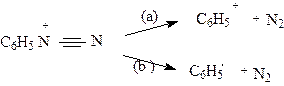 |
В первом случае реакция идет по S N 1 механизму, в другом - по -SR механизму.Поэтому соли диазония широко используются в органическом синтезе для введения различных функциональных групп:нитро-группы,галогенов,гидрокси-групп,циано-группы,алкокси-группы и др.
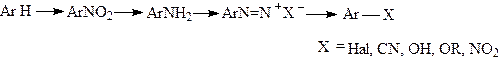 |
Замещение диазогруппы на галоген является лучшим способом введения этих заместителей в ароматическое ядро,так как позволяет получить чистый изомер в отличие от реакции прямогогалоидирования в ароматическое ядро(реакция электрофильного замещения), в результате которой всегда получается смесь изомеров.Однако реакции замещения диазогруппы на галоген протекают, как уже было сказано, по различному механизму.Для введения хлора,брома и иода используют реакцию Зандмейера.(S R). Эта реакция проводится при добавлении порошка меди или солей одновалентной меди.Образующиеся побочные продукты указывают на
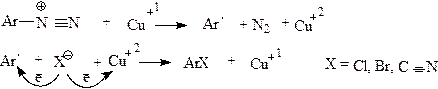 |
При введении легко окисляющихся или обратимо окисляющихся заместителей катализатор реакции становится излишним(например с иодом).Схема реакции:
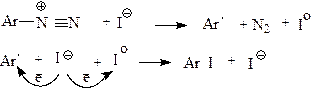 |
Однако, как уже указывалось, распад солей диазония может осуществляться по-другому механизму. Так, при нагревании водных растворов солей диазония происходит потеря азота и образуется фенил-катион, который реагирует с растворителем,выступающим в роли нуклеофила. Таким образом эта реакция мономолекулярна и является типичной реакцией мономолекулярного нуклеофильного замещения.(S N1),что определяет направление реакции:взаимодействие фенил-катиона с реагентом, обладающим наибольшей электроотрицательностью. По этой причине в водных растворах в качестве реагента выступает вода и получаются фенолы, в спиртовом растворе -эфиры, а из галогенов можно вводить только фтор.(фтор обладает наивысшей электроотрицательностью).
 |
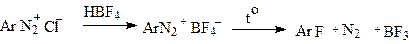 |
Существует "прямой" и "обратный " способ диазотирования. "Прямой" метод диазотирования заключается в предварительном растворении диазотируемого амина в трехкратном избытке минеральной кислоты с последующим постепенным введением в него при охлаждении до 0о раствора эквивалентного количества нитрита натрия."Обратный " метод диазотирования заключается в постепенном введении во взятый в избытке и охлажденный до 0о раствор минеральной кислоты смеси щелочного раствора диазотируемого амина и нитрита натрия. Обычно применяется при диазотировании аминокарбоновых и аминосульфокислот.Конец диазотирования определяется по иодкрахмальной бумаге(бумага,пропитанная раствором иодистого калия и крахмала). Азотистая кислота -окислитель,поэтому она, находясь в избытке,окисляет I- до Iо, который и дает характерную окраску с крахмалом.Избыток азотистой кислоты при проведении реакции с солями диазония нежелателен, поэтому избыток кислоты удаляют из реакционнной смеси после диазотирования с помощью сухой мочевины,которую добавляют до прекращения выделения газов,образующихся в результате реакции мочевины с азотистой кислотой.
Соли диазония могут вступать в реакции и с сохранением молекулы азота.Соли диазония являются по своей природе электрофильными агентами, но слабыми из-за возможности делокализации положительного заряда с участием бензольного ядра, вследствие чего они взаимодействуют только с ароматическими соединениями, активированными сильными электронодонорными заместителями, какими являются амино - и гидрокси-группы. В результате такого взаимодействия получаются азосоединения. Сама реакция протекает по схеме реакции электрофильного замещения в ароматическом ряду.
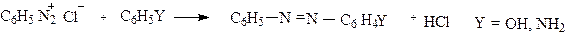 |
Этот процесс называется реакцией азосочетания. Реакция азосочетания
протекает при определенной рН среды. Для реакции с аминами оптимальные
условия реакции рН = 3,5-9; для фенолов – 9-10.
В сильно кислой среде амины могут протонироваться и терять свои
нуклеофильные свойства:
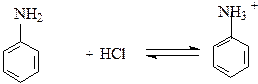 |
Основная среда способствует протеканию другой реакции: таутомерным
превращениям соли диазония в зависимости от рН среды:
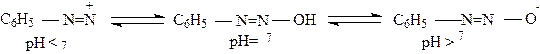 |
Лабораторные работы.
Дата добавления: 2015-07-25; просмотров: 409 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Тестовый контроль. | | | Разделение и идентификация смеси 2-х аминокислот в присутствии «свидетелей». |