
Читайте также:
|
В одну пробирку налейте 2 мл сульфата меди (II), а в другую – столько же хлорида железа (III). В обе пробирки добавьте по 1 – 2 мл раствора желтой кровяной соли  . В результате ионообменных реакций в обеих пробирках образуются новые комплексные соединения: в первой
. В результате ионообменных реакций в обеих пробирках образуются новые комплексные соединения: в первой  ; во второй – малорастворимый
; во второй – малорастворимый  (берлинская лазурь).
(берлинская лазурь).
Отметьте цвет образовавшихся осадков. Напишите молекулярные и ионные уравнения реакций получения комплексных соединений. Дайте номенклатурные названия полученных соединений.
Контрольные вопросы
1. Какие соединения называются комплексными? Как построена молекула комплексного соединения?
2. Дайте определения следующим понятиям: а) комплексообразователь; б) лиганды; в) координационное число комплексообразователя; г) внутренняя и внешняя сферы комплекса.
3. Как определяют заряд комплексного иона и степень окисления комплексообразователя?
4. Какая связь между строением атомов элементов и их способностью к комплексообразованию?
5. Какие частицы чаще всего выступают в роли а) лигандов; б) комплексообразователя?
6. Какие факторы определяют значение координационного числа комплексообразователя?
5. Какая связь между комплексообразователем и лигандами в комплексном ионе?
6. Как диссоциируют комплексные соединения; комплексные ионы?
7. Что такое константа нестойкости комплексного иона?
Задачи
1. Определите заряд и координационное число комплексообразователя в комплексных соединениях  ,
,  . Покажите, как диссоциируют комплексные соединения и комплексные ионы. Напишите выражения для констант нестойкости комплексных ионов. Назовите комплексные соединения.
. Покажите, как диссоциируют комплексные соединения и комплексные ионы. Напишите выражения для констант нестойкости комплексных ионов. Назовите комплексные соединения.
2. К раствору, содержащему 0,2335 г комплексной соли  , добавили в достаточном количестве раствор нитрата серебра. Масса осажденного хлорида серебра составила 0,1435 г. Определите координационную формулу соли.
, добавили в достаточном количестве раствор нитрата серебра. Масса осажденного хлорида серебра составила 0,1435 г. Определите координационную формулу соли.
3. Закончите уравнения химических реакций:
а) 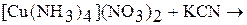
б) 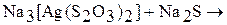
в) 
Напишите ионно-молекулярные уравнения химических реакций. В каком направлении будет протекать реакция а), если константы нестойкости исходного и образованного комплексного соединения соответственно равны  и
и  ?
?
4. Найдите массу серебра, находящегося в виде ионов в 0,5 л 0,1 М раствора  , содержащем, кроме этого 0,1 моль/л тиосульфата натрия.
, содержащем, кроме этого 0,1 моль/л тиосульфата натрия.
5. Растворы простых солей кадмия образуют с щелочами осадок гидроксида кадмия, а с сероводородом – осадок сульфида кадмия. Чем объяснить, что при добавлении щелочи к 0,05 М раствору  , содержащему 0,1 моль/л
, содержащему 0,1 моль/л  , осадок не образуется, тогда как при пропускании через раствора сероводорода выпадет осадок сульфида кадмия? Константу нестойкости иона
, осадок не образуется, тогда как при пропускании через раствора сероводорода выпадет осадок сульфида кадмия? Константу нестойкости иона  принять равной
принять равной  .
.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Практикум по неорганической химии: учеб. пособие для студ. высш. учеб. заведений / В.А. Алешин, К.М. Дунаева, А.И. Жиров и др.; под ред. Ю.Д. Третьякова – М.: Издательский центр «Академия», 2004. – 384 с.
2. Практикум по общей химии: учеб. пособие / под ред. С.Ф. Дунаева – М.: Изд-во МГУ, 2005. – 336 с.
3. Практикум по общей и неорганической химии: Учеб. пособие для химико-технологических вузов / под ред. М.Х. Карапетьянца, С.И. Дракина – М.: Изд-во «Высшая школа», 1969. – 288 с.
ПРИЛОЖЕНИЯ
Приложение 1
Константы диссоциации некоторых электролитов в водных растворах
| Формула электролита | Ступень | 
| Формула электролита | Ступень | 
|
| Кислоты | Основания | ||||

| 
| 
| 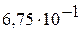
| ||

| 
| 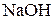
| 
| ||

| 
| 
| 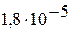
| ||

| 
| 
| II | 
| |

| 
| 
| II | 
| |

| 
| 
| II | 
| |

| 
| 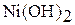
| II | 
| |

| I | 
| 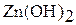
| I | 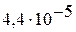
|
| II | 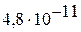
| II | 
| ||

| I | – | 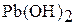
| I | 
|
| II | 
| II | 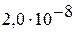
| ||

| I | 
| 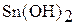
| I | 
|
| II | 
| II | 
| ||

| I | 
| 
| II | 
|
| II | 
| 
| II | 
| |
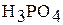
| I | 
| 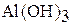
| II | 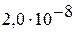
|
| II | 
| III | 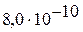
| ||
| III | 
| 
| II | 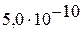
| |
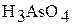
| I | 
| III | 
| |
| II | 
| 
| II | 
| |
| III | 
| III | 
| ||

| I | 
| 
| I | 
|
| II | 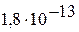
| II | 
| ||
| Окончание приложения 1 | |||||
| III | 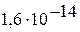
| 
| II | 
| |
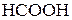
| 
| 
| II | 
| |

| 
| 
| II | 
|
Приложение 2
Произведение растворимости некоторых малорастворимых соединений
| Соединение | ПР | Соединение | ПР |

| 
| 
| 
|
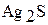
| 
| FeS | 
|
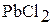
| 
| 
| 
|

| 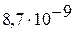
| MnS | 
|

| 
| CdS | 
|

| 
| HgS | 
|

| 
| SnS | 
|
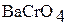
| 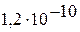
| ZnS | 
|
Приложение 3
Константа нестойкости некоторых комплексных ионов
| Комплексный ион | Константа нестойкости | Комплексный ион | Константа нестойкости |

| 
| 
| 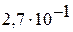
|
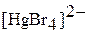
| 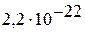
| 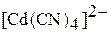
| 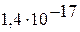
|

| 
| 
| 
|
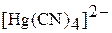
| 
| 
| 
|
| Окончание приложения 3 | |||

| 
| 
| 
|

| 
| 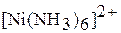
| 
|
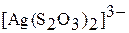
| 
| 
| 
|

| 
| 
| 
|

| 
|
ОГЛАВЛЕНИЕ
Введение. 3
Работа №1. Получение и свойства основных классов неорганических соединений 4
Работа №2. Определение молярной массы эквивалента металла. 9
Работа №3. Определение молярной массы эквивалента сложного вещества. 12
Работа №4. Установление простейшей формулы сульфида меди. 14
Работа №4. Установление формулы кристаллогидрата. 16
Работа №6. Определение молекулярной массы оксида углерода (IV) 19
Работа №7. Способы очистки веществ от примесей. 22
Работа №8. Тепловые эффекты химических реакций. 28
Работа №9. Скорость химических реакций. 34
Работа №10. Катализ и ингибирование химических реакций. 40
Работа №11. Химическое равновесие. 41
Работа №12. Приготовление растворов заданной концентрации. Проверка концентрации приготовленного раствора. 44
Работа №13. Реакции обмена в растворах электролитов. 52
Работа №14. Гидролиз солей. 55
Работа №15. Окислительно-восстановительные реакции. 59
Работа №16. Получение и свойства комплексных соединений. 62
Библиографический список. 67
Приложения. 68
Приложение 1. 68
Константы диссоциации некоторых электролитов в водных растворах. 68
Приложение 2. 69
Произведение растворимости некоторых малорастворимых соединений. 69
Приложение 3. 69
Константа нестойкости некоторых комплексных ионов. 69
Дата добавления: 2015-07-25; просмотров: 105 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| В окислительно-восстановительных реакциях | | | Учебное пособие |