
Читайте также:
|
& Литература: [1], [3], [8], [6].
Периодическая система элементов была создана Д. И. Менделеевым задолго до появления квантовой механики чисто эмпирическим путем. Эта таблица наглядно отображает периодическую зависимость химических свойств элементов от заряда ядра атомов.
Квантовая механика дает теоретическое обоснование свойств элементов, исходя из строения атомов, объясняет, в частности, и периодическое изменение химических свойств с ростом порядкового номера элемента в таблице.
Порядковый номер элемента в таблице Менделеева совпадает с числом элементарных зарядов ядра. Столько же электронов входит в состав нейтрального атома этого элемента.
Считается, что каждый электрон атома движется в эффективном центральном поле, образованном ядром и остальными электронами. Поэтому его состояние характеризуется квантовыми числами n, l, и m. Д. Хартри и В. А. Фок разработали метод самосогласованного поля, позволяющий рассчитать энергетические уровни и волновые функции одно-частичных состояний электронов в атоме.
Идея метода самосогласованного поля заключается в следующем. Вначале задается выражение потенциальной энергии, грубо описывающее эффективное поле, в котором движется каждый электрон. С этим выражением вычисляются волновые функции, описывающие состояния электронов в атоме. Они позволяют уточнить вид эффективного поля и найти для него новые волновые функции. Повторяя эту процедуру последовательно несколько раз, можно решить задачу достаточно точно.
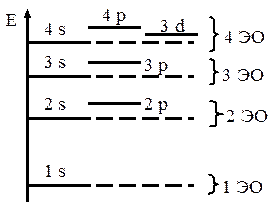 Рис. 30.1
Рис. 30.1
|
Вычисления приводят к схеме энергетических уровней одно-частичных состояний, изображенной на рис. 30.1 без соблюдения масштаба. Существенной особенностью этой схемы является то, что группы сравнительно близко расположенных уровней разделены значительными энергетическими интервалами. Каждую такую группу, а также совокупность относящихся к ней состояний электронов называют энергетической оболочкой (ЭО). На рис. 30.1 изображены четыре нижние энергетические оболочки. В первых трех оболочках большим числам n и l соответствуют более высокие уровни. В четвертой энергетической оболочке уровень 3d ниже, чем 4p, но выше, чем уровень 4s.
Для определения того, какой уровень выше, можно использовать эмпирические правила В.М. Клечковского: 1) тот уровень выше, для которого больше n + l; 2) при равных n + l выше уровень с большим n.
Энергия атома зависит от распределения электронов по одно-частичным состояниям, то есть от электронной конфигурации. Представляет интерес электронная конфигурация основного состояния атома. Она должна обеспечть наименьшее значение энергии атома без нарушения запрета Паули.
Число подлежащих заполнению состояний на каждом уровне зависит от квантовых чисел n, l, и m.
Совокупность состояний, соответствующих фиксированному квантовому числу n, называют слоем. Слои с n = 1, 2, 3, 4,… принято называть, соответственно, K, L, M, N,… -слоями.
Совокупность состояний с фиксированными числами n и l называют электронной оболочкой (подслоем). Не путайте электронную оболочку с энергетической оболочкой. Если n = 2 и l = 0, то используют название «2s-оболочка». Если n = 3 и l = 1, то говорят: «3p-оболочка». Аналогичным образом именуют и другие оболочки.
Фиксированному значению орбитального квантового числа l соответствуют 2 l + 1 состояния с различными числами m. Эти состояния отличаются проекциями орбитального момента импульса. Учитывая две возможные ориентации спина (s = ±1/2), число подлежащих заполнению состояний оболочки с квантовым числом l оказывается равным 2 (2 l + 1). В результате получается, что в n-м слое может разместиться число электронов,
равное 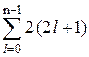 = 2 n2. (30.1)
= 2 n2. (30.1)
Зная энергетическую схему одно-частичных состояний и число состояний для каждого энергетического уровня, нетрудно установить электронную конфигурацию атомов. Рассмотрим некоторые примеры. Они отражены в приведенной ниже таблице.
В ячейках таблицы указано число электронов, находящихся в каждой электронной оболочке.
В полностью заполненной энергетической оболочке нет места для электронов другого атома, а размещение такого электрона на вышележащих свободных уровнях энергетически не выгодно. Не выгоден также уход электрона с полностью заполненной энергетической оболочки поскольку наименьшей энергией обладает система электронов с нулевым спином (все электроны «спарены»). Вот почему атомы с полностью заполненными энергетическими оболочками относятся к инертным газам. В приведенной таблице таковыми являются атомы He, Ne, Ar, Kr.
У атомов H, Li, Na, Ka в s-ом подслое почти пустой энергетической оболочки находится единственный электрон. Энергия связи его с атомом мала. Поэтому названные атомы активно вступают в химическую реакцию с теми, у которых энергетические оболочки почти заполнены, например, со фтором F или с хлором Cl. Электронная конфигурация верхней энергетической оболочки у фтора 2s22p5, а у хлора – 3s23p5. В обоих случаях до полного заполнения и уменьшения энергии при «спаривании» не хватает одного электрона.
Для характеристики электронной конфигурации атома в целом достаточно указать лишь электронную конфигурацию верхней энергетической оболочки, что обычно и делается, в том числе и в последней колонке приведенной таблицы. Чтобы получить полную электронную конфигурацию, следует слева приписать конфигурации предшествующих инертных газов.
Химические свойства атома определяются верхней, частично заполненной энергетической оболочкой. В реакциях в первую очередь участвуют наиболее далекие от ядра (валентные) электроны, для которых достаточно велико радиальное квантовое число nr= n – l – 1. Валентные электроны находятся в s- и p- оболочках (l = 0 и l = 1). Их число не превышает восьми
(2 + 6).
| Заряд ядра (в элем. заряах) | Элемент | Слои | Энергетичес-кие оболочки | Электронные конфигурации | |||||||
| K | L | M | N | ||||||||
| Оболочки | |||||||||||
| 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | ||||
| H | 1 ЭО | 1s1 | |||||||||
| He | 1s2 | ||||||||||
| Li | 2 ЭО | 2s1 | |||||||||
| Ne | 2s22p6 | ||||||||||
| Na | 3 ЭО | 3s1 | |||||||||
| Ar | 3s23p6 | ||||||||||
| K | – | 4 Э О | 4s1 | ||||||||
| Ca | – | 4s2 | |||||||||
| Sc | 3d14s2 | ||||||||||
| Ti | 3d24s2 | ||||||||||
| V | 3d34s2 | ||||||||||
| Zn | 3d104s2 | ||||||||||
| Ga | 3d104s24p1 | ||||||||||
| Kr | 3d104s24p6 |
Анализируя заполнение оболочек при последовательном переходе к атомам с все большим числом электронов, можно заметить изменение порядка заполнения, начиная с четвертой энергетической оболочки. Вслед за оболочкой 3p, заполнение которой завершается в атоме Ar, заполняется 4s-оболочка следующего слоя (K, Ca), хотя 3d-подслой имеет 10 свободных состояний. Лишь после Ca происходит заполнение вакантных состояний 3d-оболочки вплоть до Zn. Особенный порядок заполнения имеет место и у редкоземельных элементов (лантанидов). В атомах, начиная с лантана 57La и заканчивая лютецием Lu, происходит заполнение вакантных состояний 4f-оболочки 4-го слоя, в то время как число электронов, более удаленных от центра (оболочек 5s, 5p, 5d, 5f, 6s) остается неизменным. По этой причине химические свойства этих элементов так мало отличаются, что Д. И. Менделеев поместил все эти элементы в одну клетку своей таблицы. Аналогичная ситуация имеет место и для актинидов (элементов с порядковыми номерами от 89 до 103).
Поскольку химические свойства атомов определяются электронными конфигурациями верхних энергетических оболочек, то аналогичным электронным конфигурациям соответствуют близкие химические свойства. Это объясняет открытый Менделеевым закон периодичности свойств элементов. Например, электронные конфигурации у Be, Ma, Ca, соответственно, – 2s2, 3s2, и 4s2. Так что атомы этих элементов имеют по два валентных электрона в s-оболочках. По этой причине химические свойства указанных элементов сходны. Аналогичная ситуация имеет место и для других атомов, относящихся к одной группе таблицы Д.И. Менделеева.
В конце брошюры приведена современная форма таблицы Д.И. Менделеева, которая отличается от устаревшей, но еще не вышедшей из употребления короткой формы, в которой наряду с группами рассматриваются подгруппы элементов.
? Контрольные вопросы
1. Назовите принципы, лежащие в основе квантово-механического обоснования периодической системы Д. И. Менделеева.
2. Расскажите об энергетическом спектре одно-частичных состояний многоэлектронных атомов.
3. Расскажите об электронных слоях и оболочках.
4. Докажите равенство (30.1).
5. Расскажите о порядке заполнения электронных оболочек при последовательном переходе к атомам с все большим числом электронов.
6. В чем причина периодичности свойств химических элементов?
7. Запишите и объясните полную электронную конфигурацию конкретного атома (по указанию преподавателя).
8. Каковы химические свойства атомов, имеющих следующие электронные конфигурации: 2s22p4, 3s2 3p1, 3d54p1, 4d105s1?
Дата добавления: 2015-07-11; просмотров: 73 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Атом гелия | | | Молекула водорода |