
Читайте также:
|
Хімічне нікелювання досить широко впроваджується в гальванотехніки завдяки цінним властивостям покриття: високої рівномірності, великої твердості, значною корозійної стійкості і зносостійкості.
Хімічно обложений нікель володіє більш високими захисними властивостями через меншу пористості, ніж електрохімічно обложений нікель, а також тому, що опади, що містять у своєму хімічному складіфосфор, більш стійкі до агресивних середовищ, ніж чистий нікель.
Внаслідок своїх специфічних властивостей хімічне нікелювання знаходить застосування в багатьох галузях машинобудування та приладобудування для покриття металевих виробів складного профілю (з глибокими каналами і глухими отворами), для збільшення зносостійкості тертьових поверхонь деталей машин; для підвищення корозійної стійкості в середовищі киплячій луги та перегрітої пари; для заміни хромового покриття (з наступною термічною обробкою хімічного нікелю), щоб використовувати замість корозійно-стійкої сталі більш дешеву сталь, покриту хімічним нікелем, для нікелювання великогабаритної апаратури, для покриття непровідних матеріалів, пластмас, скла, кераміки тощо
Згідно сучасним уявленням, сумарний процес хімічного нікелювання включає в себе, принаймні, три реакції-
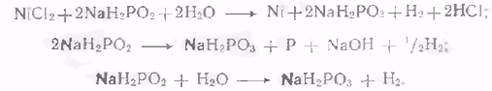
Механізм процесу хімічного нікелювання дуже складний Згідно з останніми дослідженнями [32], механізм реакцій при хімічному нікелювання носить наступний характер.
Першою стадією процесу є реакція взаємодії гіпофосфіти з водою. Ця реакція, що протікає на каталітичної поверхні, полягає в заміні водню з зв'язку Р - Н в молекулі гіпофосфіти на групу-ОН з води. Реакція, що описує це взаємодія, виражається рівнянням
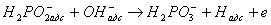 (1)
(1)
Утворюються при реакції електрон і адсорбований атом водню в умовах кислої і слабощелочной середовища взаємодіють з іоном водню по реакції
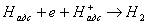
Сумарна реакція взаємодії гіпофосфіти з водою відповідає рівнянню
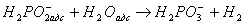 (2)
(2)
В умовах лужного середовища (рН> 9) утворюються при окислюванні гіпофосфіти в фосфен електрон і атом водню з зв'язку Р - Н, взаємодіючи з водою, приводять до молізаціі за типом електрохімічної десорбції:
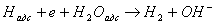 (3)
(3)
Враховуючи, що друга константа дисоціації нона фосфіти досить велика, можна вважати, що молізація водню безпосередньо пов'язана з дисоціацією цього іона. У цьому випадку реакція електрохімічного десорбції може бути представлена рівнянням:
 (4)
(4)
З рівняння наочно видно, що процес окислення гіпофосфіти водою призводить до зниження рН розчину. Зниження рН розчину може виявитися і результатом безпосередньої нейтралізації іона Н 2 РО 3 -іоном ОН -.
При наявності в розчині іонів нікелю електрони відновлюють їх до металу:
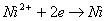
Сумарну реакцію відновлення іонів нікелю гіпофосфіти можнопредставіть у вигляді наступних рівнянь:
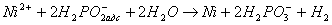 (5)
(5)
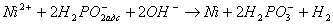 (6)
(6)
При протіканні реакцій (5) і (6) можуть також йти реакції (2) - (4), які призводять до зниження коефіцієнта використання гіпофосфіти.
Одночасно з відновленням нікелю протікає реакція відновлення гіпофосфіти до елементарного фосфору. Реакція, що приводить до утворення фосфору, пов'язана з розривом зв'язків Р - Н, Р - О і Р - ОН в молекулі гіпофосфіти. Перебіг зазначеної реакції може бути представлене в такий рівнянням.
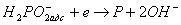 (7)
(7)
Сумарна реакція, включаючи і реакцію взаємодії гіпофосфіти з водою, що постачає електрони, виразиться рівнянням:
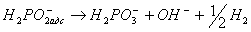 (8)
(8)
У відповідності з рівнянням (7) експериментально визначається встановлена залежність вмісту фосфору в покриттях від рН розчину, а саме збільшення кількості фосфору в осаді зі зменшенням величини рН.
Процес утворення Ni - Р-покриттів починається спонтанно тільки на деяких каталітично активних металах. До їх числа відносяться нікель, залізо кобальт паладій і алюміній. Однак нікелеве покриття можна нанести і на інші метали (наприклад, на мідь або латунь) якщо їх після занурення в розчин привести в контакт з більш електронегативний металом, ніж нікель (наприклад, з алюмінієм). У результаті контактування на поверхні покривається металу за рахунок роботи виникає при цьому гальванічного елемента утворюється шар нікелю, на якому далі триває процес відновлення.
Для покриття каталітично неактивних металів (мідь і її сплави) був запропонований інший метод, який полягає в нанесенні на поверхню покривається каталітично активного металу (наприклад, паладію).Паладій наноситься зануренням деталей на кілька секунд у паладієвий розчин. Слід зазначити, що на деяких металах взагалі не вдається отримати нікелевого покриття. До таких металів відноситься олово, свинець, кадмій, цинк, вісмут і сурма.
 Численними дослідженнями встановлено, що кислі розчини мають деякі переваги в порівнянні з лужними велику стійкість до високої температури, більш високу швидкість протікання процесу і найкращу якість покриттів. Однак і лужні розчини аміачні представляють інтерес в деяких випадках.
Численними дослідженнями встановлено, що кислі розчини мають деякі переваги в порівнянні з лужними велику стійкість до високої температури, більш високу швидкість протікання процесу і найкращу якість покриттів. Однак і лужні розчини аміачні представляють інтерес в деяких випадках.
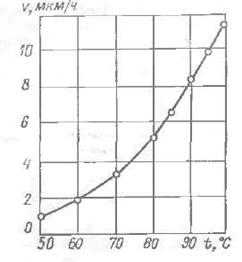
Рис. 2. Вплив температури на швидкість утворення покриття.
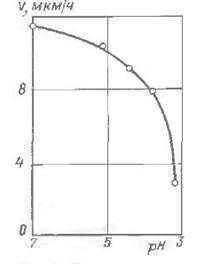
Рис. 3. Вплив кислотності розчину на швидкість утворення покриття.
Кислі розчини. Одним з основних факторів, що визначають процес нікелювання є температура Встановлено, що при низьких температурах процес не буде проходити. З рис. 2 видно, що відновлення нікелю зростає з підвищенням температури і в розчинах, нагрітих до 98-99 ° С, досягає максимальних значень.
Значний вплив на процес відновлення хімічного нікелю надає кислотність розчину. У процесі нікелювання відбувається мимовільне підкислення розчину. Найкращі результати щодо швидкості відновлення нікелю та якості покриття виходять при рН 4.5-5.0 [33]. При зниженні кислотності розчину до рН 6.0-6.5 швидкість осадження нікелю збільшується, проте підтримку рН на цьому рівні утруднено, тому що в ході процесу утворюються малорозчинні нікелеві з'єднання (рис. 3).
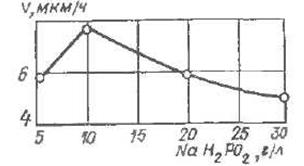 При збільшенні концентрації гіпофосфіти від 5 до 10 г / л швидкість утворення покриття дещо зростає, але при концентрації гіпофосфіти 30 г / л швидкість утворення покриття знижується (рис. 3).
При збільшенні концентрації гіпофосфіти від 5 до 10 г / л швидкість утворення покриття дещо зростає, але при концентрації гіпофосфіти 30 г / л швидкість утворення покриття знижується (рис. 3).
Рис. 4. Вплив концентрації гіпофосфіти натрію на швидкість утворення покриття.
При дослідженні розчинів для нікелювання з низьким вмістом гіпофосфіти встановлено, що зміна концентрації нікелевої солі мало відбивається на швидкостіпроцесу (рис. 4) Солі органічних кислот (гліколевої, оцтової та лимонної) мають вплив на процес відновлення, тому що підтримують рН при оптимальному значенні і впливають на швидкість відновлення нікелю.
Деякі дослідники [33] пропонують застосовувати як буферних сполук солі органічних двоосновних насичених кислот (янтарної, малонової та глутарової). Багато роботи показують, що швидкість відновлення нікелю, а також і якість покриття залежать значною мірою від концентрації та природи буферного з'єднання.
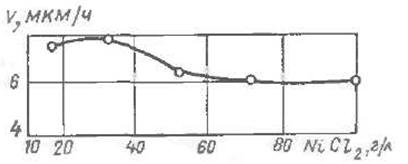
Рис. 5 Вплив концентрації хлористого нікелю на швидкість утворення покриття.
У силу каталітичної природи процесу нікчемні домішки в розчині можуть мати значний вплив на його перебіг. Сторонні речовини потрапляють у розчин у вигляді домішок до основних реагентів, і при коригуванні розчину концентрація цих домішок може бути настільки значною, що шкідливо позначиться на процесі. Дані дослідження [31, 32, 34] показують, що незначні кількості іонів роданида і хлористого свинцю (0,1 г / л) повністю припиняють процес як у кислих, так і в лужних нікелевих розчинах. Шкідливий вплив на процес надають солі кадмію, причому в лужних нікелевих розчинах більшою мірою, ніж у кислих нікелевих. Присутність в кислому розчині хлористих солей цинку, магнію, алюмінію, заліза і натрію (до 0,1 г / л) не робить помітного впливу на процес. При підвищенні концентрації хлористого заліза до 3 г / л швидкість процесу сильно знижується.
Крім того, на процес нікелювання можуть впливати речовини, які утворюються в результаті окисно-відновних реакцій (фосфен і кислота) [35]. Так, іони фосфіти утворюють нерозчинний з'єднання - фосфен нікелю. Випадання осаду погано відбивається на швидкості процесу та якості покриття і утрудняє коригування розчину. Випадання фосфіти нікелю сприяють висока температура і мала кислотність розчину.
Для запобігання випаданню опадів фосфіти нікелю необхідно вводити в розчин речовини, здатні утворювати з нікелем комплексні з'єднання і не надають негативного впливу на реакцію відновлення [31-35].
Найбільш ефективними комплексообразователя є гліцин і лимоннокислий натрій. Введення в розчин гліцину перешкоджає випаданню фосфіти, проте невисока швидкість осадження нікелю в даних умовах викликає необхідність поєднання цієї добавки з іншими речовинами (наприклад, з оцтовокислим натрієм).
Накопичення фосфіти в розчині сповільнюється при використанні не тільки гліцину, але й інших амінокислот, α-амінопропіоновой, амінобутіловой, аміноянтарной, амінодіуксусной.
Стабілізаторами розчинів можуть бути сульфід свинцю, тіосечовина, тіосульфат натрію, хромат свинцю, сульфід вісмуту. Дія стабілізаторів засноване на тому, що вони ізолюють фосфіти від взаємодії з розчином. Стабілізатори адсорбуються переважно на що утворюються в ході реакції частинках колоїдного розміру, перешкоджаючи їх перетворення в центри кристалізації, на яких би осаджувався нікель, тим самим запобігаючи розкладання розчину Стабілізатори підвищують швидкість осадження покриттів і скорочують витрати гіпофосфіти.
Лужні розчини. Основним недоліком лужних ванн є їх нестійкість, пов'язана з звітрювання аміаку при високій температурі. Крім того, відзначається знижена швидкість відновлення нікелю в порівнянні з кислими розчинами. Однак при наявності в складі лужних розчинів таких комплексоутворювачів, як лимоннокислий натрій і аміак полегшується коригування розчину, що дозволяє здійснювати тривалий ведення процесу.
Багатьма авторами [31-34, 35] встановлено, що зміна концентрації нікелевої солі в широких межах не відбивається помітно на швидкості відновлення нікелю, в той час як зміна концентрації гіпофосфіти надає значний вплив на процес нікелювання. Однак не рекомендується використовувати розчини з високою концентрацією гіпофосфіти (понад 25-30 г / л) через можливість протікання процесу в об'ємі розчину з утворенням порошкоподібного нікелю. Висока концентрація нікелевих солей (понад 50-60 г / л) призводить до погіршення якості покриттів (появі шорсткості). Зниження концентрації солей нікелю (нижче 20 г / л) та підвищення її (понад 70 г / л) знижують швидкість осадження нікелю.
Так само як і в кислих розчинах, великий вплив на ведення процесу робить температура розчину. Найбільша швидкість утворення покриття досягається при високій температурі.
Максимум швидкості нікелювання отримано при концентрації хлористого амонію 25 г / л. Зміна його концентрації менше 20 г / л або більше 75 г / л знижує швидкість нікелювання, а покриття виходять темними. Аналогічно впливає зміна концентрації лимоннокислого натрію. При відсутності лимоннокислого натрію осадження покриття припиняється.
У лужних і кислих розчинах при молярному відношенні солі нікелю до гіпофосфіти, рівному 0,5, швидкість нікелювання за інших рівних умовах істотно зростає. Для підтримки процесу на постійному рівні рекомендується періодично додавати до розчину витрачаються компоненти (у вигляді концентрованих розчинів) - сіль нікелю і гіпофосфіт. Підтримка оптимальної концентрації компонентів лужного розчину дозволяє тривалий час зберігати максимальну швидкість нікелювання на практично постійному рівні.
Дата добавления: 2015-07-11; просмотров: 144 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Активування. | | | Структура і фізико-хімічні властивості Ni - Р-покриттів |