
|
Читайте также: |
| RNa + H |
\ NaCl
колонка, наполненная катионообменником в H-форме
У RH + Na
,-титруют стандартным раствором NaOH
HCl
Рис. 24.7. Определение NaCl методом ионообменной хроматографии
Ионный обмен используется для разделения различных неорганических и органических ионов, например, с целью устранения мешающего влияния одних ионов при обнаружении других, выделения определённых ионов из смеси и т.д. На рис. 24.7 показан простейший вариант использования ионообменной хроматографии для количественного определения веществ.
Современными хроматографическими методами анализа, в которых используется ионообменное разделение, являются ионная и ион-парная хроматография.
Ионной хроматографией называется колоночная ионообменная жидкостная хроматография с кондуктометрическим детектированием.
В качестве неподвижной фазы в ионной хроматографии используют поверхностно-пористые ионообменники, состоящие из твёрдого ядра, покрытого тонким слоем ионита. Для таких сорбентов характерны диаметр зёрен меньше 50 мкм, низкая ионообменная ёмкость, механическая прочность, химическая устойчивость, быстрое время установления ионообменного равновесия.
| разделяющая колонка |
| подавляющая колонка |
Высокочувствительное кондуктометрическое определение ионов возможно только при невысокой фоновой электропроводности потока жидкости, поступающей в детектор. По этой причине предложено два основных варианта ионной хроматографии:

|
Схема двухколоночной ионохроматографической системы показана на рис. 24.8.
| элюент | насос | ввод образца | ||
| ионообменник с малой обменной ёмкостью |
ионообменник с большой обменной ёмкостью
|
| Рис. 24.8. Схема двухколоночной ионохроматографической системы |
При прохождении через подавляющую колонку фоновый электролит превращается в соединение с низкой электропроводностью, а определяемый ион - в соединение с высокой электропроводностью. Например, при разделении катионов щелочных металлов в качестве элюента используется раствор HNO3. В разделяющей колонке, заполненной катионообменником, происходит ионный обмен и разделение катионов. В подавляющей колонке находится анионобменник в OH- форме. При прохождении через подавляющую колонку анионы разделяемых солей и нитрат-ионы, входящие в состав элюента, полностью обмениваются на гидроксид-ионы. Таким образом, HNO3 превращается в H2O, а соли щелочных металлов - в соответствующие гидроксиды (сильные электролиты).
Ион-парной хроматографией называется вариант жидкостной хроматографии, при котором в подвижную фазу добавляют реагент, в состав которого входит гидрофобный ион, хорошо адсорбирующийся на поверхности неподвижной фазы - силикагеля с привитыми алкильными группами (см. рис. 24.1). В качестве ион-парных реагентов при разделении катионов обычно используют алкилсульфаты или алкилсульфонаты, а при разделении анионов - ионы тетраалкиламмо- ния.
Принято считать, что разделение и удерживание веществ в ион- парной хроматографии обусловлено двумя механизмами:
• сорбцией ион-парного реагента на поверхности неподвижной фазы и превращении её в ионообменник;
• взаимодействием разделяемых веществ и ион-парного реагента в подвижной фазе с образованием ионных пар, которые затем адсорбируются на неподвижной фазе.

|
Ион-парная хроматография используется для разделения ионизированных веществ, которые обладают хорошей растворимостью в полярной подвижной фазе, незначительным сродством к неполярной неподвижной фазе и не могут быть удовлетворительно разделены в условиях обычной обращённо-фазовой ВЭЖХ.

|
| + |
©
В качестве примера на рис. 24.9 показана жидкостная хроматограмма эта- нольного извлечения из корня барбариса, содержащая смесь алкалоидов, прото- бербериновой группы (пик, отмеченный значком *, соответствует берберину - см. рис. 20.10), полученная с помощью микроколоночного жидкостного хроматографа «Миллихром-4». Колонка длиной 64 мм и диаметром 2 мм. Неподвижная фаза
24.4.2. Эксклюзионная хроматография
В эксклюзионной хроматографии (гель-хроматографии) разделение основано на различиях в размерах и форме молекул.
В качестве твёрдого носителя в гель-хроматографии используют различные сетчатые полимеры («гели»). Неподвижной фазой является элюент, находящийся в порах зёрен твёрдого носителя, подвижной фазой - этот же элюент, протекающий вдоль слоя частиц полимера. В процессе хроматографирования более мелкие молекулы проникают в поры геля и задерживаются в находящейся в них неподвижной фазе. Более крупные молекулы не проникают в поры и поэтому движутся быстрее. Таким образом, выход компонентов смеси из колонки происходит в порядке уменьшения их молекулярных масс (рис 24.10).

| 6 8 10 время, мин Рис. 24.9. Хроматограмма этанольного извлечения из корня барбариса |
| - Separon SGX - C18 (диаметр час бента 5 мкм). Подвижная фаза - смесь ацетонитрила и водного 5 -10-2 М K 40:60) c добавлением 2-10-3 М додецил- сульфата натрия. Детектор - сиект гетрический (260 нм). |
Величина коэффициента распределения (D) в эксклюзионной хроматографии может находиться в пределах от 0 до 1. Для крупных молекул, не способных проникать в поры геля, D = 0, следовательно, удерживаемый объём равен свободному объёму колонки - VR = Vm. В случае молекул, размер которых позволяет им свободно диффундировать через пористый материал, D = 1 (поскольку состав подвижной и неподвижной фаз одинаков), следовательно, удерживаемый объём равен сумме свободного объёма колонки и объёма жидкости, находящейся в порах - VR = Vm + Vs. Для молекул промежуточного размера Vm < VR < VS. Поскольку диапазон возможных значений D в эксклюзионной хроматографии очень узок, то для эффективного разделения в данном виде хроматографии приходится применять длинные колонки или несколько соединённых друг с другом колонок.

|
| Рис. 24.10. Принцип эксклюзионной хроматографии |
| сефадексы, агарозные гели, полиакриламидные гели и др органические ВМС с небольшим числом поперечных связей |
| сополимеры стирола и дивинилбензола, поливинилацетатные гели и др |
| силикагели и пористые стёкла имеют фиксированный размер пор, который не изменяется ни при каких условиях |
Большинство из мягких гелей гидрофильны. Процесс хромато- графирования на мягких гелях называется гель-фильтрационной хроматографией. Полужёсткие гели в основном гидрофобны. Процесс хроматографирования на таких гелях называется гель-проникающей хроматографией.
В качестве растворителей в эксклюзионной хроматографии используют воду, диметилформамид, хлороформ, толуол и т.д. Выбор растворителя зависит от типа используемого геля, вида разделяемых веществ, применяемой системы детектирования.

| V |
| V |
| R |
| маленькие молекулы, свободно диффундирующие через пористый материал |

| сигнал ^_________ — детектора |
| молекулы промежуточного крупные молекулы, размера не проникающие в поры D = 0 |
| D = 1 |
Основное назначение гель-хроматографии - разделение смесей высокомолекулярных соединений (а также высокомолекулярных и низкомолекулярных) и определение молекулярномассового распределения полимеров. Как и ионообменная хроматография гель- хроматография может быть колоночной и плоскостной, проводиться как в «классическом» варианте, так и в высокоэффективном.
ГЛАВА 25
ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕКТРОХИМИЧЕСКИХ МЕТОДОВ АНАЛИЗА. КОНДУКГОМЕТРИЯ
Электрохимическими называют методы анализа, основанные на использовании процессов, происходящих в электрохимической ячейке.
25.1. Основные понятия, связанные с электрохимическими методами анализа
Электрохимической ячейкой называется система, состоящая из пары электродов и электролита, контактирующих между собой.
Электродом называется граница раздела, на которой электронный механизм переноса заряда (направленное движение электронов) меняется на ионный (направленное движение ионов). В менее строгом смысле под термином «электрод» обычно подразумевают проводник электрического тока с электронной проводимостью. Электролитом называется среда, в которой происходит перенос заряда в результате направленного движения ионов. Электроды, входящие в состав электрохимической ячейки, могут находиться в одном растворе либо в разных растворах, контактирующих друг с другом с помощью солевого мостика или через пористую перегородку (рис. 25.1). Ячейки первого типа называются ячейками без жидкостного соединения, второго типа - ячейками с жидкостным соединением.
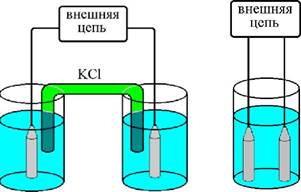 Рис. 25.1. Электрохимическая ячейка с жидкостным соединением (слева) и без жидкостного соединения (справа)
Рис. 25.1. Электрохимическая ячейка с жидкостным соединением (слева) и без жидкостного соединения (справа)
|
В состав электрохимической ячейки должно входить, по крайней мере, два электрода.
Электрод, на котором происходят электрохимические процессы, приводящие
к возникновению 'аналитического сигнала
Эталон, относительно которого измеряется потенциал индикаторного электрода.
| Индикаторный электрод, который за время измерения оказывает значительное влияние на состав анализируемого раствора, называется рабочим |
| электрод сравнения |
индикаторным электрод
ЭЛЕКТРОДЫ, ВХОДЯЩИЕ В СОСТАВ ЭЛЕКТРОХИМИЧЕСКОЙ ЯЧЕЙКИ
Потенциал электрода сравнения должен:
• быть хорошо воспроизводимым;
• не изменяться во времени;
• не зависеть от состава анализируемого раствора, действия электрического тока и т.д.
На практике в качестве
/ электродов сравнения чаще
i.
\ всего применяют хлоридсереб-
ряный и каломельный электроды. Например, хлоридсеребря- ный электрод представляет собой серебряную проволочку, покрытую AgCl и помещённую в раствор KCl (рис. 25.2).
| /------ 1 ----- 2 |
AgCl^ + e г Ag^ + Cl-
| 0,059 lg aci - |
| E = E |
AgCl/Ag,Cl-
| хлоридсеребряного |
При использовании насыщенного раствора KCl по
Рис. 25.2. Насыщенный хлоридсеребряный
тенциал
электрод 1 - серебряная проволока, 2 - внутренний насыщенный раствор KCl, 3 - электрода при температуре 25 внешний насыщенный раствор KCl, 4 - ас- °С равен +0,222 В. бестовое волокно
В некоторых случаях в состав электрохимической ячейки может входить ещё и третий электрод, называемый вспомогательным. Этот электрод служит источником электронов либо, наоборот, играет роль стока электронов и тем самым обеспечивает возможность протекания электрического тока через ячейку. Как правило, ни сила тока, ни потенциал вспомогательного электрода не измеряются. Вспомогательный электрод изготавливают из инертного материала.
Если в электрохимической ячейке протекают электрохимические реакции, то в зависимости от режима работы она может быть:
 электрическая энергия, передаваемая извне, преобразуется в химическую
электрическая энергия, передаваемая извне, преобразуется в химическую
|
энергия химической реакции превращается в электрическую

|
А
| Kt+ | |
| An- |
| кинетическая |
Если во внешней цепи не протекает электрический ток, то потенциал индикаторного электрода подчиняется уравнению Нернста и называется равновесным. Если во внешней цепи начинает протекать электрический ток, то это приводит к отклонению величины потенциала электрода от рассчитанной по уравнению Нернста. Такое явление называется поляризацией, а электрод (или электрохимическая ячейка) - поляризованным.
ПОЛЯРИЗАЦИЯ
концентрационная
|
Концентрационная поляризация (цс) возникает вследствие медленной диффузии вещества из объёма раствора к поверхности электрода и приводит к уменьшению потенциала электрода. В том
случае, когда измеряют величину равновесного потенциала, концентрационная поляризация является нежелательным процессом, и её стремятся свести к минимуму. В вольтамперометрических методах анализа она, наоборот, необходима. Для уменьшения концентрационной поляризации, анализируемый раствор постоянно перемешивают и кроме того, плотность тока на индикаторном электроде должна быть незначительной. В вольтамперометрии измерение проводят в разбавленных неперемешиваемых растворах и применяют электроды с большой плотностью тока.
Кинетическая поляризация, или перенапряжение (ц) обусловлена медленным переносом электронов на поверхности электродов. Величина кинетической поляризации зависит от природы окислительно-восстановительной системы и материала электрода.

|
25.2. Классификация электрохимических методов анализа
Согласно IUPAC

|
| I |
| прямые |
В табл. 25.1 приведена классификация основных электрохимических методов анализа в зависимости от измеряемого параметра.
Табл. 25.1.
Классификация основных электрохимических методов анализа по измеряемому параметру
|
ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
I
косвенные
используется зависимость электрического параметра от концентрации вещества
изменение величины электрического параметра используется для обнаружения конечной точки титрования
25.3. Кондуктометрия
Кондуктометрия - это совокупность электрохимических методов анализа, основанных на измерении удельной электропроводности (или сопротивления) растворов электролитов.
25.3.1. Теоретические основы и классификация
| G 1 S S G =----------- = к— p i t |
Любое вещество характеризуется своим электрическим сопротивлением (R). Величина обратная сопротивлению называется электропроводностью или электрической проводимостью (G). Для раствора электролита, находящегося между двумя электродами, площадь поверхности которых равна S и расстояние между которыми равно t:
R = p i
S
где к- удельная электропроводность раствора
В аналитических целях G не используется, так как она зависит от размеров и формы проводника. Удельная электропроводность, характеризующая лишь токопроводящую среду, не зависит от этих параметров.
Размерность R - Ом, G - См (сименс) = Ом'1, р - Ом-см (в СИ Ом-м), к - См-см'1 (в СИ См-м-1). Удельная электропроводность (См-м-1) численно равна силе тока, проходящего через слой раствора с поперечным сечением, равным единице, под действием градиента потенциала 1В на единицу длины.
Удельная электропроводность связана с молярной концентрацией эквивалента вещества (моль/л):
к = 1-10-3ХС,
где X - молярная (эквивалентная) электропроводность (См-см2/моль)
При малых и средних концентрациях (до 2-4 моль/л) удельная электропроводность раствора прямо пропорциональна молярной концентрации электролита в растворе. При больших концентрациях эта зависимость отклоняется от прямолинейной, а при концентрациях больше 8-10 моль/л удельная электропроводность раствора начинает даже уменьшаться. При бесконечном разбавлении раствора величина удельной электропроводности стремится к нулю.
Молярная электропроводность равна произведению абсолютной скорости движения иона на постоянную Фарадея. При уменьшении концентрации электролита и уменьшении ионной силы скорости движения ионов возрастают, поэтому величина X увеличивается. При бесконечном разбавлении молярная электропроводность достигает некоторого предельного (ненулевого) значения, называемого предельной молярной электропроводностью X<. Согласно закону Кольрауша:
Значения X< для некоторых ионов приведены в табл. 25.2.
Табл. 25.2
Значения X< для некоторых катионов и анионов
|
Самую высокую среди катионов имеет катион гидроксония, а
среди анионов - гидроксид-ион. Это связано с их способностью передавать свой заряд через молекулы растворителя по особому «эстафетному» механизму, на что затрачивается значительно меньше времени, чем для непосредственного перемещения к электроду.
| (-0~0-ч |
| IX |
| К |
| Рис.25.3. Простейшая ячейка для измерения электропроводности |
бесконтактная
контактная
 низкочастотная < 0,1 МГц
высокочастотная > 0,1 МГц
низкочастотная < 0,1 МГц
высокочастотная > 0,1 МГц
|
25.3.2. Измерение аналитического сигнала
Контактные кондуктометрические измерения проводят в ячейке для измерения электропроводности. Простейшая ячейка представляет собой стеклянный сосуд с двумя плоскопараллельными платиновыми электродами (рис. 25.3). Для уменьшения концентрационной поляризации используют платинированную (покрытую платиновой чернью) платину, имеющую большую площадь поверхности. Раствор, находящийся в ячейке, постоянно перемешивается. Ячейку подключают к источнику переменного тока, имеющего частоту около 1000 Гц. Непосредственно измеряемой величиной в кондуктометрии является не электропроводность, а сопротивление. Сопротивление раствора можно измерять с помощью моста Уитстона Мосты переменного тока могут быть уравновешенными и неуравновешенными. В случае уравновешенного моста (рис. 25.4) величины сопротивлений R1, R2 и R3 должны быть такими, чтобы мост пришёл в состояние равновесия, при котором сила тока в измерительной диагонали равна нулю (или имеет минимальное значение).
R3R2 Ri
Измерить с удовлетворительной точностью величины £ и S трудно, поэтому вначале измеряют сопротивление раствора, удельная электропроводность которого точно известна. В качестве такого стандарта используется
„, ^ раствор KCl. Например, при 18°С
Рис. 25.4 Мост Уитстона, используемый при кондуктометрических измере- к(0,1 моль/кг KCl) — 0,011100 ниях

| переменное эталонное сопротивление R3 |
| £ |
| R |
| к= |
| x |
| RxS |
Cм•см-. Отношение £/S— 0 называется постоянной ячейки.
0 к RKCl
| Kx = |
| R |
= KKCl"
R
x
25.3.4. Практическое применение
Прямая кондуктометрия основана на существовании (в области разбавленных и умеренно концентрированных растворов) прямолинейной зависимости между к и С. Поскольку электропроводность раствора является аддитивной величиной, прямая кондуктометрия обладает малой избирательностью и используется лишь в тех случаях, когда достаточно знать общую концентрацию ионов в растворе, например, при контроле качества воды, определении суммарного содержания солей в природных водах или биологических жидкостях. Кондуктометрический детектор является одним из детекторов, используемых в ВЭЖХ. Прямую кондуктометрию используют также для определения различных физико-химических характеристик вещества (Ka, Ks и др.).
Кондуктометрическое титрование основано на изменении удельной электропроводности раствора в зависимости от количества добавленного титранта. Чаще всего в кондуктометрическом титровании используются протолитические реакции, реже всего - окислительно-восстановительные. Электропроводность исходного раствора должна заметно отличаться от электропроводности реагента или продукта реакции. Константу ячейки при кондуктометрическом титровании знать не обязательно, поскольку определяют не абсолютное значение к, а её изменение в процессе титрования. Главное, чтобы в процессе титрования константа ячейки оставалась постоянной.
В качестве примера на рис. 25.5 показана кривая титрования раствора HCl раствором NaOH. До точки эквивалентности величина удельной электропроводности раствора уменьшается вследствие того, что ионы H3O+ заменяются гораздо менее подвижными ионами Na+. После точки эквивалентности в растворе появляется избыток подвижных OH- ионов, что вновь приводит к значительному увеличению электропроводности. Конечной точке титрования соответствует точка пересечения нисходящей и восходящей ветвей кривой титрования.
Кондуктометрическое титрование может быть использовано в тех случаях, когда трудно провести визуальное обнаружение конечной точки титрования - при анализе мутных и окрашенных растворов, а также в случае определения веществ в сильно разбавленных растворах (10-4 М и меньше).
25.3.5. Понятие о высокочастотной кондуктометрии
В высокочастотной кондуктометрии (осциллометрии), применяемой, главным образом, в виде высокочастотного титрования, используется электрический ток высокой частоты (мегагерцы). Электроды в ячейках для высокочастотного титрования не соприкасаются с анализируемым раствором. Существует два типа таких ячеек: емкостная и индуктивная. При использовании емкостных ячеек измеряют изменение частоты генератора в процессе титрования. Индуктивная ячейка помещается внутрь электромагнитной катушки. При титровании происходит изменение величины индуктивности.
К преимуществам высокочастотной кондуктометрии относится возможность анализа растворов как с очень малой, так и с очень большой электропроводностью. Электроды находятся вне раствора, поэтому не происходит их поляризации. Метод высокочастотного титрования может быть использован для анализа агрессивных сред, растворов, находящихся в замкнутых сосудах и т.д. Основной недостаток - более высокая стоимость оборудования.
 Рис. 25.5. Кривая титрования HCl раствором NaOH с указанием вкладов отдельных ионов (без учёта разбавления раствора)
Рис. 25.5. Кривая титрования HCl раствором NaOH с указанием вкладов отдельных ионов (без учёта разбавления раствора)
|
326
ГЛАВА 26
ПОТЕНЦИОМЕТРИЧЕСКИЙ И КУЛОНОМЕТРИЧЕСКИЙ МЕТОДЫ АНАЛИЗА
26.1. Потенциометрический метод анализа
Потенциометрическими называют методы анализа, основанные на измерении зависимости равновесного электродного потенциала от активности определяемого иона.
26.1.1. Общая характеристика и классификация
При потенциометрических измерениях используется электрохимическая ячейка, работающая в режиме гальванического элемента. В состав ячейки входит индикаторный электрод, потенциал которого зависит от активности определяемого иона или от активности хотя бы одного из компонентов протекающей химической реакции, и электрод сравнения (чаще всего хлоридсеребряный), величина потенциала которого постоянна. Величина потенциала индикаторного электрода связана с активностью определяемого иона уравнением Нернста (см. главу 7).
E = E0 + ^ = E0 + 0059 lg^OL (при 298 К) nF ared n _ ared
ЭДС гальванического элеме»*»AE = Eср - Eинд+ E^I ^—диффузионный
| прямая ("ионометрия") |
потенциал
ПОТЕНЦИОМЕТРИЯ
Дата добавления: 2015-09-07; просмотров: 174 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Ионообменное равновесие | | | Практическое применение. Понятие об ионной и ион-парной хроматографии 2 страница |