
|
Читайте также: |
косвенная
("потенциометрическое титрование")
| Измеряют величину ЭДС и по ней находят активность (концентрацию) |

| определяемого иона E |
| система должна быть обратимой |
Измеряют величину ЭДС, которая изменяется в ходе химической реакции между определяемым веществом и титрантом
E

|
| желательно, чтобы хотя бы одна из полуреакций была обратимой |
26.1.2. Условия измерения аналитического сигнала
Измерение ЭДС гальванического элемента проводят в условиях, которые близки к термодинамическим:
• сила тока, протекающего через ячейку, должна быть равна 0;
• время, в течение которого проводится измерение, должно быть достаточным для достижения равновесия.
При измерении ЭДС в таких условиях можно считать, что величина соотношения q0x / Qred у поверхности электрода равна величине
этого соотношения в растворе
МЕТОДЫ ИЗМЕРЕНИЯ ЭДС

|
| Используют потенциометр Погендорфа см. курс физической химии |
| Используют электронный вольтметр с очень большим входным сопротивлением (1013 Ом) |
Приборы, позволяющие определять величину рХ (отрицательного логарифма активности иона Х в растворе), в комплекте с соответствующими ионо- селективными электродами, называются иономерами. Если прибор предназначен для измерения активности только катионов водорода, то его называют рН- метром.
26.1.3. Индикаторные электроды
| металлические |
| (ионо селективные) |
Ь ИНДИКАТОРНЫЕ _J мембранные ЭЛЕКТРОДЫ (ионоселективные)
| имеют ионную проводимость |
имеют электронную проводимость
Металлические электроды могут быть
изготовлены из металла, образующего восстановленную форму обратимой окислительно-восстановительной реакции
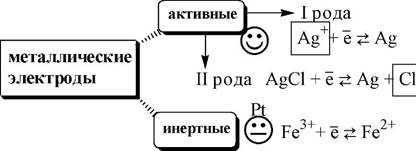 материал электрода не участвует в окислительно-восстановительной реакции и служит лишь переносчиком электронов
материал электрода не участвует в окислительно-восстановительной реакции и служит лишь переносчиком электронов
|
Ионоселективные электроды (согласно IUPAC) - это сенсоры (чувствительные элементы, датчики), потенциалы которых линейно зависят от lg активности определяемого иона в растворе.
В состав большинства ионоселективных электродов входит полупроницаемая мембрана, представляющая собой тонкую плёнку, отделяющую внутренний раствор (стандартный) от внешнего (анализируемого) и способную пропускать преимущественно ионы только одного вида (рис. 26.1)
мембранный электрод
полупроницаемая мембрана
| внешнии раствор «1(A) =? |
| внутренний раствор «2(A) = const |
| Ем — Ei - E2 — 0. |
| A |
| A |
const
| A |
Ем — const + 0,059lg«i
| Е2 |
E1
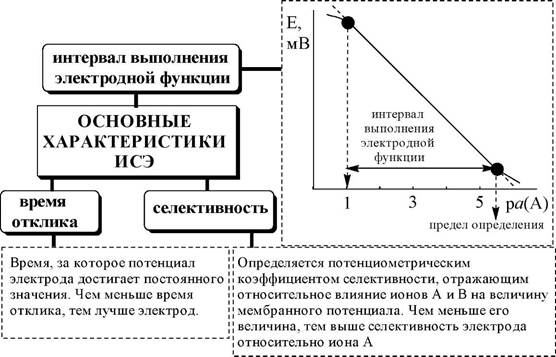
Рис. 26.1. Принцип работы мембранного электрода К основным характеристикам ионоселективного электрода отно-
сят
|
Согласно рекомендациям IUPAC различают следующие виды ионоселективных электродов:
| имеют стеклянную мембрану обладающую селективностью по отношению к определённому иону |
имеют кристаллическую мембрану,
изготовленную из индивидуального кристаллического соединения или гомогенной смеси кристаллических веществ
| с жёсткой матрицей (стеклянные) |
| с кристаллическими мембранами |
фт орид-селект ивный электрод, имеющий мембрану из LaF3
первичные ионоселективные электроды
I
стеклянный рН - чувствительный электрод
ИОНОСЕЛЕКТИВНЫЕ ЭЛЕКТРОДЫ
\
электроды с подвижными носителями
сенсибилизированные
электроды
газочувствительные
датчики, состоящие из индикаторного электрода и
| К-селект ивный электрод на основе валиномицина |
электрода сравнения и имеющие газопроницаемую
для отделения анализируемого раствора от тонкой плёнки промежуточного раствора электролита
электрод для определения углекислого газа на основе
| имеют жидкую мембрану - раствор ионообменника или "нейтрального переносчика"в органическом растворителе, удерживаемый на пористом полимере или заключённый в полимерную матрицу |
стеклянного рН - чувствительного электрода
| мембрану или воздушный зазор субстрата с образованием веществ, на которые реагирует электрод электрод для определения пенициллина, содержащий фермент пенициллиназу и стеклянный рН- чувствительный электрод |
ферментные
датчики, в которых ИСЭ покрыт плёнкой, содержащей фермент, способный вызвать реакцию превращения
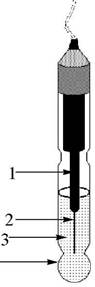
Стеклянный электрод для измерения рН (рис.26.2) имеет тонкую рН-чувствительную мембрану, изготовленную из специального стекла, содержащего 22% Na2O, 6% CaO и 72% SiO2. Внутри электрода находится 0,1 М HCl, насыщенный хлоридом серебра, и хло- ридсеребряный электрод сравнения. Перед началом работы электрод, который хранился в сухом виде, вымачивают в 0,1 М HCl. Для того чтобы электрод работал, на внутренней и внешней сторонах мембраны должна образоваться тонкая плёнка гидратированного геля. Ионы водорода должны вытеснить ионы Na+ из пустот на поверхности стекла.
В основе работы стеклянного электрода для измерения рН лежит ионообменное равновесие
| H+ |
| H |
| стекло |
раствор
const + 0,059lgaH+
| потенциалы потенциал асимметрии внутреннего (даже если составы и внешнего внутреннего и внешнего электродов растворов будут сравнения идентичными, потенциал электрода не будет равен нулю), изменяющийся в процессе эксплуатации электрода Из-за наличия потенциала асимметрии перед началом работы стеклянный электрод для измерения рН градуируют по стандартным буферным растворам |
л
Рис. 26.2. Стеклянный электрод 1 - внутренний хлоридсеребряный электрод; 2 - серебряная проволочка; 3 - 0,1 М HCl, насыщенный AgCl; 4 - стеклянная рН- (табл. 26.1). чувствительная мембрана)
Табл. 26.1.
Стандартные буферные растворы, используемые для
| Буферная система | рН (20 °С) |
| 0,05 М раствор тетраоксалата калия | 1,675 |
| насыщенный (20 °С) раствор гидротартрата калия | 3,557 |
| 0,05 М раствор гидрофталата калия | 4,002 |
| 0,025 M KH2PO4 / 0,025 М Na2HPO4 | 6,881 |
| 0,01 M раствор тетрабората натрия | 9,225 |
| Стеклянный электрод может быть использован для измерения рН в ограниченном диапазоне рН, зависящем от сорта стекла, из которого изготовлена мембрана. измеренное значение л измеренное значение pH больше истинного ^ ApH = 0 pH меньше истинного |
' © © 1 Р
конкуренция с ионами щелочных металлов
26.1.4. Прямая потенциометрия
|
| E = |
| / |
В прямой потенциометрии концентрацию (активность) определяемого вещества рассчитывают, исходя из величины ЭДС гальванического элемента. Чаще всего индикаторным в прямой потенциометрии является ионоселективный электрод. Прямые потенциометриче- ские измерения, в которых используется ионоселективный электрод, называются ионометрией. Данный метод анализа характеризуется простотой и экспрессностью методик, недорогой аппаратурой
|
26.1.5. Потенциометрическое титрование
Потенциометрическим титрованием называется метод анализа, основанный на регистрации изменения потенциала индикаторного электрода в процессе химической реакции между определяемым веществом и титрантом.
В основе потенциометрического титрования могут лежать различные протолитические, окислительно-восстановительные, осади- тельные реакции и реакции комплексообразования, протекающие количественно, стехиометрично и с приемлемой скоростью. Выбор индикаторного электрода для выполнения потенциометрического титрования зависит от используемой реакции. Например, при кислотно- основном титровании обычно используют стеклянный рН- чувствительный электрод, при окислительно-восстановительном может быть использован инертный платиновый электрод, при комплек- сонометрическом - электрод, чувствительный по отношению к ионам определяемого металла и т.д.
Конечную точку титрования обнаруживают с использованием кривой титрования, её производных, а также методом Грана. На рис. 26.3 показаны различные варианты обнаружения конечной точки титрования фосфорной кислоты гидроксидом натрия. Конечной точке титрования на исходной кривой титрования соответствует точка максимального наклона (точка перегиба) кривой, на её первой производной - точка максимума, второй производной - точка пересечения прямой, соединяющей две ветви кривой, с осью абсцисс. При использовании метода Грана конечной точке титрования соответствует точка пересечения прямых.
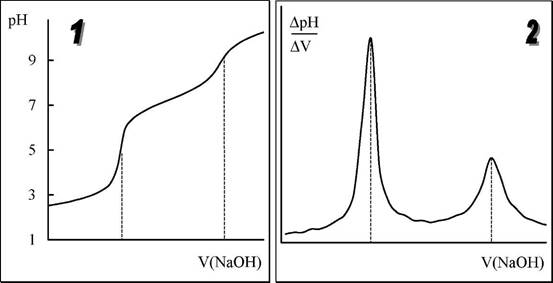
|
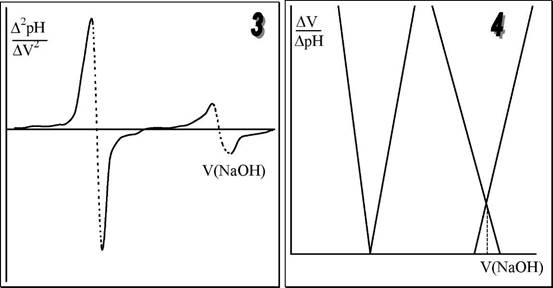 Рис. 26.3. Кривая потенциометрического титрования фосфорной кислоты (1), её первая (2) и вторая (3) производные, а также обнаружение конечных точек титрования методом Грана (4).
Рис. 26.3. Кривая потенциометрического титрования фосфорной кислоты (1), её первая (2) и вторая (3) производные, а также обнаружение конечных точек титрования методом Грана (4).
|
Преимущества потенциометрического титрования перед титрованием с визуальным обнаружением конечной точки титрования заключаются в том, что:
• отсутствует субъективная ошибка обнаружения конечной точки титрования
• определение веществ может проводиться в окрашенных и мутных растворах;
• имеется возможность дифференцированного титрования компонентов смеси (в особенности, при использовании неводного титрования);
• возможна автоматизации процесса титрования.
26.2. Кулонометрический метод анализа
Кулонометрическими называют электрохимические методы анализа, основанные на измерении количества электричества, прошедшего через электролитическую ячейку при электрохимическом окислении или восстановлении вещества на рабочем электроде.
26.2.1. Общая характеристика и классификация
Кулонометрия - это безэталонный метод анализа. Массу определяемого вещества при кулонометрических определениях рассчитывают непосредственно из величины аналитического сигнала. В основе кулонометрии лежат законы Фарадея для электролиза. Математическое выражение объединённого закона Фарадея имеет вид
MQ
m = — Q nF
где m - масса вещества, окисленного (восстановленного) в процессе электролиза; M - молярная масса вещества; n - число электронов, участвующих в электродной реакции; F - постоянная Фарадея (F = 96487 Кл/моль «9,65-104 Кл/моль), Q - количество электричества, Кл.
При проведении кулонометрических определений необходимо, чтобы:
• отсутствовали побочные химические и электрохимические процессы, и выход по току был равен 100%;
• определяемый элемент окислялся (восстанавливался) только до одной точно известной степени окисления;
| гальваностатическая |
• был известен способ определения количества электричества или момента завершения реакции.
потенциостатическая
I = const
| V |
| E = const |
| условия измерения КУЛОНОМЕТРИЯ |
| определяемое вещество реагирует непосредственно на поверхности ^электрода у |
| I |
| практическое применение |
| Z |
определяемое вещество непосредственно не участвует в электродной реакции, но взаимодействует с продуктом ^электролиза,
| прямая |
кулонометрическое титрование
| обычно при I= const |
обычно при E = const
26.2.2. Прямая кулонометрия
Прямые кулонометрические определения обычно проводят при постоянном потенциале.
Прямая кулонометрия при постоянной силе тока используется в тех случаях, когда определяемое вещество находится на поверхности электрода или предварительно выделено на этой поверхности.

| 0 "эл Рис. 26.5. Зависимость I от t в потен- циостатической кулонометрии |
| -k't |
| = Io10 SD |
Принципиальная схема установки для потенциостатических ку- лонометрических определений показана на рис. 26.4.
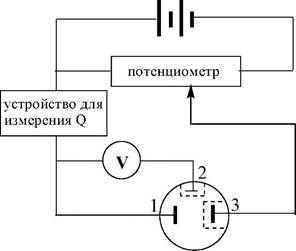
|
| ячейка |
| Рис. 26.4. Принципиальная схема установки для потенциоста- тических кулонометрических определений 1) рабочий электрод; 2) электрод сравнения; 3) вспомогательный электрод |
Если на рабочем электроде протекает электрохимическая реакция первого порядка, то сила тока с течением времени уменьшается по экспоненциальному закону (рис. 26.5):
-kt
It = V
k = 2,303k'
VS
где S - площадь поверхности электрода, D - коэффициент диффузии электроактивного вещества; V - объём раствора в ячейке; S - толщина диффузионного слоя.
Для того чтобы электрохимическая реакция прошла до конца, теоретически требуется бесконечно большое время. Практически при проведении электролиза всегда остаётся некоторый фоновый ток (1ф), обусловленный превращением примесей, поэтому обычно электролиз считают законченным,
когда сила тока станет равной 0,01 - 0,001 от первоначального значения. Для ускорения процесса электролиза необходимо создать такие условия, чтобы величина k в зависимости I от t была как можно большей. Для этого используют рабочий электрод с большой площадью поверхности, берут малый объём раствора и, кроме того, раствор в ячейке постоянно перемешивают (это приводит к уменьшению 8).
Количество электричества, затраченное на электрохимическое превращение вещества, в потенциостатической кулонометрии равно:
t эл
Q = Q общ - Q ф = \ Idt -1 ф t
t0
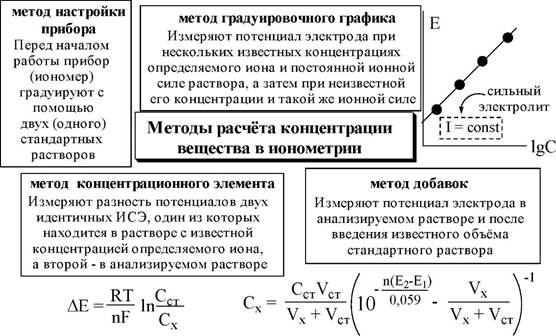
Для определения количества электричества, прошедшего через электролитическую ячейку, используют следующие приёмы:

|
Кулонометром называется электролитическая ячейка, подключаемая последовательно с кулонометрической ячейкой, в которой при замыкании электрической цепи со 100% выходом по току протекает электрохимическая реакция известной стехиометрии.
| КУЛОНОМЕТРЫ I |
| X |
| J |
| газовые |
Количество электричества определяют по оптической плотности окрашенного раствора
гравиметрические
| фотометрические j I------ ► I2 I гл |
крахмал синее
окрашивание
титрационные
C остоят и Pt-анода и катода, изготовленного из металла (Ag, Cu), ионы которого находятся в растворе. Количество электричества определяют по увеличению массы катода " " " 1Кл = 1 ",118 мг Ag 1Кл = 0,3295 мг Cu
Количество электричества определяют по объёму газа, выделившегося при электролизе, например, при электролизе воды
| iI^-NE2S2O3 |
1Кл = 0,1791 см3 (н у.) I смеси H2 и O2
Количество электричества определяют путём титрования продукта электродной реакции
Прямая кулонометрия используется для определения соединений Cu, Au, Ag, Tl, Sb и других элементов, а также для хинонов и гид- рохинонов, многоатомных фенолов, нитро-, нитрозо- и азо- соединений, галогенопроизводных и т.д.
26.2.3. Кулонометрическое титрование
В кулонометрическом титровании аналитическим сигналом является не объём стандартного раствора титранта, а количество электричества, которое необходимо для его получения. Кулонометрическое титрование, в отличие от прямой кулонометрии, используется для определения электронеактивных веществ. Измерения в кулонометри- ческом титровании проводятся при постоянной силе тока. Количество электричества при таком режиме измерения равно произведению силы тока на время электролиза (рис. 26.6).
| Рис. 26.6. Зависимость I от t в галь ваностатической кулонометрии |

Схема установки для кулоно- метрического титрования приведена на рис. 26.7.
Рис. 26.7. Принципиальная схема установки для кулонометрического титрования 1) устройство для измерения разности потенциалов; 2) сопротивление; 3) источник постоянного тока; 4) хронометр; 5) рабочий электрод; 6) вспомогательный электрод
| I |
| Q |
| t |
| эл |
Рабочий электрод изготовлен, как правило, из платины, золота, ртути (для катодных процессов). Вспомогательный электрод - платиновая проволока, реже - графит. Вспомогательный электрод обычно отделяют от раствора диафрагмой, изготовленной из пористого стекла или пластмассы.
В основе кулонометрического титрования могут лежать различные типы химических реакций.
A- ------------- /*" 2,4,6-трибромфенол
| внЧ |
| + |
| H20 *OH" |
[Вг-Ч- ^ВГ2(
| B |
| кислотно- основное |
| осадительное |
HA фенол
окислительно-восстановительное
КУЛОНОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
комплексометрическое
2-
HY3f ZnY
| AgBr |
| Ag+r |
| HgNH3Y2 |
| Ag |
Zn2+
Титрант в кулонометрическом титровании обычно получают в электролитической ячейке в результате электрохимической реакции, протекающей на рабочем электроде (внутренняя генерация титранта). Если это по той или иной причине невозможно, электрогенерацию титранта проводят в специальном устройстве, находящемся вне ячейки (внешняя генерация титранта).
 ,'н+ w-h2o Ag —►;Ag+' добавляют в избытке для
"V ^ЦУ обеспечения 100% выхода по току
,'н+ w-h2o Ag —►;Ag+' добавляют в избытке для
"V ^ЦУ обеспечения 100% выхода по току
|
i-^ (V;
Конечную точку кулонометрического титрования обнаруживают так же, как и в других титриметрических методах анализа: визуально с помощью индикатора или инструментальными методами (потенцио- метрически, амперометрически, фотометрически и др.).
Перед проведением титрования обычно проводят предварительное титрование (предэлектролиз). При этом генерируют небольшое количество титранта, необходимое для достижения конечной точки титрования фонового раствора. Цель предварительного титрования - удаление возможных примесей посторонних веществ и устранение погрешности, связанной с состоянием поверхности рабочего электрода.
Преимущества кулонометрического титрования перед другими титриметрическими методами анализа заключаются в том что:
• титрант не нужно готовить, стандартизировать и хранить;
• можно получать титранты (например, Fe2+ или Cl2), которые сложно или невозможно приготовить обычным способом;
• титрант легче «дозируется» (отрегулировать силу тока значительно легче, чем добавить точный объём титранта);
• раствор в процессе титрования не разбавляется;
• в процессе предэлектролиза можно устранить мешающее влияние примесей;
• одну и ту же ячейку можно использовать для любого вида титрования;
• процесс анализа можно легко автоматизировать.
ГЛАВА 27
ВОЛЬТАМПЕРОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА
Вольтамперометрия - совокупность электрохимических методов анализа, основанных на исследовании зависимости силы тока в электролитической ячейке от потенциала погружённого в анализируемый раствор индикаторного микроэлектрода, на котором протекает электрохимическая реакция с участием определяемого вещества.
27.1. Принцип измерения аналитического сигнала.
В вольтамперометрии применяют двух- или трёх- электродные (более совершенные!) ячейки. Устройство трёхэлектродной ячейки показано на рис.27.1.
На индикаторном микроэлектроде происходит электрохимическая реакция: окисление (на аноде) или восстановление (на катоде) определяемого вещества. В Рис. 27.1. Трёхэлектродная ячейка для зависимости от природы ин- вольтамперометрических измерений дикаторного электрода вольт-

|

|
| (мкА) |

|
1) электрод сравнения; 2) измерительный амперометрические методы электр°д; 3) вспом°гательный электрод анализа разделяют на:

|
| используется ртутный капающий электрод 4 вращающиеся стационарные |
| другие электроды 1 1 |
Индикаторный электрод имеет очень малую площадь поверхности, плотность тока на нём очень большая, поэтому электрод является поляризованным: при прохождении электрического тока через ячейку его потенциал изменяется.
В качестве индикаторного электрода в классической полярографии используют ртутный капающий электрод, который представляет собой толстостенный стеклянный капилляр, имеющий внутренний диаметр 0,05 - 0,1 мм, связанный шлангом с капилляром для ртути. Преимуществом ртутного капельного электрода является то, что благодаря его постоянному обновлению, электрохимический процесс всё время происходит на незагрязнённой продуктами реакции поверхности, поэтому даже при длительном проведении процесса электролиза получаются хорошо воспроизводимые результаты. Ртутный капающий электрод может быть использован в достаточно широком интервале потенциалов:
| окисление ртути |
| © |
восстановление H или катиона фонового электролита
©
-1-1,5 B (для H+), -2 B (для K+)
В собственно вольтамперометрии в качестве индикаторных используются вращающиеся электроды, изготовленные из различных металлов (платины, золота, серебра) или углеродных материалов (графит, стеклоуглерод и т.д.). Поверхность таких электродов не возобновляется, поэтому перед регистрацией каждой новой вольтампе- рограммы необходимо проводить их очистку. Очистка может быть:
• механической (полировка тонкой наждачной и фильтровальной бумагой);
• химической (обработка концентрированной азотной кислотой при нагревании);
• электрохимической (воздействие в течение некоторого времени большого положительного или отрицательного потенциала).
В инверсионной вольтамперометрии применяют также стационарный (висячая ртутная капля) и плёночный ртутный электроды.
| + 0,4 B (в кислой среде), + 0,06 B (в щелочной) |
Площадь поверхности электрода сравнения во много раз больше площади поверхности индикаторного электрода, поэтому плотность тока на нём в десятки тысяч раз меньше, чем на индикаторном электроде. Можно считать, что электрод сравнения не поляризуется, его потенциал при прохождении электрического тока через
ячейку остаётся постоянным. В простейшей двухэлектродной ячейке для проведения полярографических определений в качестве электрода сравнения (и одновременно вспомогательного электрода) может использоваться донный слой ртути. Потенциал такого электрода сравнения зависит от состава раствора, находящегося в ячейке, поэтому двухэлектродные ячейки используют в тех случаях, когда знание точной величины потенциала индикаторного электрода необязательно, например, при проведении рутинных количественных определений.
Дата добавления: 2015-09-07; просмотров: 261 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Практическое применение. Понятие об ионной и ион-парной хроматографии 1 страница | | | Практическое применение. Понятие об ионной и ион-парной хроматографии 3 страница |